汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx气体,NOx的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)⇌2NO(g)△H反应温度不平衡常数的关系如下表:
则△H___________________ 0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) ⇌ 2NO2(g)的反应速率不反应物浓度的关系如下表所示
已知反应速率公式为 V 正=K 正×c m(NO)・cn(O2),则 m=___________________ , K 正=___________________ L2・mol-2・s-1
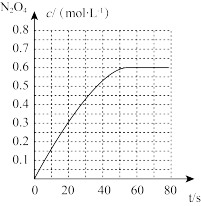
(3)在某温度下(恒温),向体积可变的容器中充人 NO2气体,发生反应 2NO2(g) ⇌N2O4(g),气体分压随时间的变化关系如图 1 如示。

①该反应的压力平衡常数 KP=___________________ 。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________ kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2在 b 电极上的电极反应式为___________________ 。
(1)通过资料查得 N2(g)+O2(g)⇌2NO(g)△H反应温度不平衡常数的关系如下表:
| 反应温度/℃ | 1538 | 2404 |
| 平衡常数 | 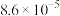 |  |
则△H
(2)在 800℃时,测得 2NO(g)+O2(g) ⇌ 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/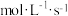 | |
| C0(NO) | C0(O2) | |
| 0.01 | 0.01 | 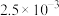 |
| 0.01 | 0.02 | 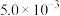 |
| 0.03 | 0.02 | 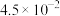 |
已知反应速率公式为 V 正=K 正×c m(NO)・cn(O2),则 m=
(3)在某温度下(恒温),向体积可变的容器中充人 NO2气体,发生反应 2NO2(g) ⇌N2O4(g),气体分压随时间的变化关系如图 1 如示。

①该反应的压力平衡常数 KP=
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2在 b 电极上的电极反应式为
2019·河南郑州·一模 查看更多[3]
更新时间:2020-01-01 11:46:19
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
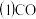 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:
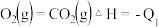

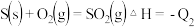

则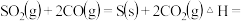
______  ;
;
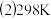 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: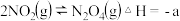

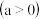 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
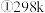 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
______ 。
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
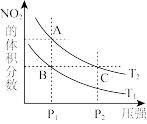
下列说法正确的是______
 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,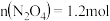 ,则此时
,则此时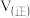
______ 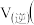 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 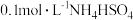 溶液中滴加
溶液中滴加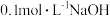 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

 水的电离程度最大的是
水的电离程度最大的是______ ;
 其溶液中
其溶液中 的数值最接近
的数值最接近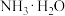 的电离常数K数值的是
的电离常数K数值的是______ 。
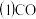 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。已知:

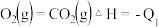

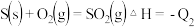

则
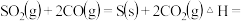
 ;
;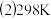 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: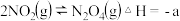

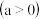 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
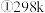 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
下列说法正确的是
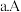 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,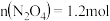 ,则此时
,则此时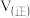
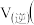 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 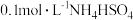 溶液中滴加
溶液中滴加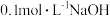 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
 水的电离程度最大的是
水的电离程度最大的是 其溶液中
其溶液中 的数值最接近
的数值最接近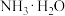 的电离常数K数值的是
的电离常数K数值的是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
(1)已知: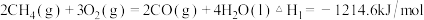

请写出 燃烧热的热化学方程式:
燃烧热的热化学方程式: ______ .
(2)在不同温度下反应 的平衡常数K如下表:
的平衡常数K如下表:
①该反应的
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.
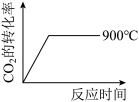
②900℃时发生上述反应, 的转化率随时间变化如图所示,若到达平衡后加压,则
的转化率随时间变化如图所示,若到达平衡后加压,则 的转化率将
的转化率将 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同
______ ,正反应速率将 ______ . 其他条件相同时,请在图中画出 时
时 的转化率随时间变化的示意图
的转化率随时间变化的示意图______ .
③在 时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是
时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 填编号
填编号
______ ,平衡后与C中各物质的百分含量相等的组有 ______  填编号
填编号
(3)以二甲醚 、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式:
、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
①假设该燃料电池中盛有
 KOH溶液,放电时参与反应的氧气在.
KOH溶液,放电时参与反应的氧气在.
②标准状况下的体积为 ,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为
,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .

(1)已知:
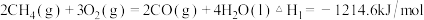

请写出
 燃烧热的热化学方程式:
燃烧热的热化学方程式: (2)在不同温度下反应
 的平衡常数K如下表:
的平衡常数K如下表: 温度 | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K |  | 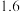 | 1 |  | 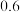 |
①该反应的

 填“
填“ ”、“
”、“ ”或“
”或“ ”
” .
.②900℃时发生上述反应,
 的转化率随时间变化如图所示,若到达平衡后加压,则
的转化率随时间变化如图所示,若到达平衡后加压,则 的转化率将
的转化率将 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同
 时
时 的转化率随时间变化的示意图
的转化率随时间变化的示意图③在
 时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是
时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 填编号
填编号
 填编号
填编号
| A | B | C | D | E | |
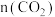 | 3 | 1 | 0 | 1 | 1 |
 | 2 | 1 | 0 | 1 | 2 |
 | 1 | 2 | 3 | 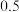 | 3 |
 | 5 | 2 | 3 | 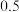 | 1 |
(3)以二甲醚
 、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式:
、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: ①假设该燃料电池中盛有

 KOH溶液,放电时参与反应的氧气在.
KOH溶液,放电时参与反应的氧气在.②标准状况下的体积为
 ,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为
,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为
您最近半年使用:0次
【推荐3】2023年环境日中国主题是“建设人与自然和谐共生的现代化”。 甲醚化是有效利用二氧化碳资源实现固碳的有效手段之一,在环境保护方面显示出较大潜力。已知
甲醚化是有效利用二氧化碳资源实现固碳的有效手段之一,在环境保护方面显示出较大潜力。已知 与
与 作用的反应有:
作用的反应有:
① 甲醚化:
甲醚化: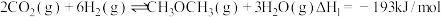 ;
;
②逆水煤气变换反应:
回答下列问题:
(1)写出 与氢气反应生成气态二甲醚的热化学方程式:
与氢气反应生成气态二甲醚的热化学方程式:________________ 。
(2)某研究机构在容积为 的密闭容器中加入
的密闭容器中加入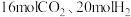 ,容器内只发生反应①和②,探究一定温度和压强对
,容器内只发生反应①和②,探究一定温度和压强对 平衡转化率的影响,利用手持技术获取数据,关系如图所示。随温度的升高,
平衡转化率的影响,利用手持技术获取数据,关系如图所示。随温度的升高, 的转化率先减小后增大的原因是
的转化率先减小后增大的原因是________ ,图中压强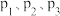 由大到小的顺序为
由大到小的顺序为________ 。
(3)已知图中 点的温度和压强下,
点的温度和压强下, 的平衡转化率为
的平衡转化率为 ,测得此时水蒸气的浓度为
,测得此时水蒸气的浓度为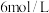 ,反应①的平衡常数为
,反应①的平衡常数为________ 。
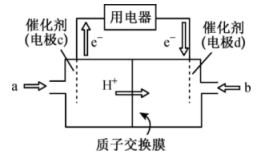
(4)工业上把生成的二甲醚用于制作燃料电池(如图),质子交换膜左右两侧溶液均为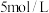 的
的 溶液。则电极
溶液。则电极 为
为________ (填“正”或“负”)极,电极c上发生的电极反应为________________ ,反应一段时间后,左侧 溶液的浓度
溶液的浓度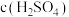
________ (填“>”“<”或“=”)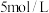 。
。
 甲醚化是有效利用二氧化碳资源实现固碳的有效手段之一,在环境保护方面显示出较大潜力。已知
甲醚化是有效利用二氧化碳资源实现固碳的有效手段之一,在环境保护方面显示出较大潜力。已知 与
与 作用的反应有:
作用的反应有:①
 甲醚化:
甲醚化: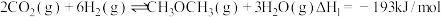 ;
;②逆水煤气变换反应:

回答下列问题:
(1)写出
 与氢气反应生成气态二甲醚的热化学方程式:
与氢气反应生成气态二甲醚的热化学方程式:(2)某研究机构在容积为
 的密闭容器中加入
的密闭容器中加入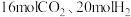 ,容器内只发生反应①和②,探究一定温度和压强对
,容器内只发生反应①和②,探究一定温度和压强对 平衡转化率的影响,利用手持技术获取数据,关系如图所示。随温度的升高,
平衡转化率的影响,利用手持技术获取数据,关系如图所示。随温度的升高, 的转化率先减小后增大的原因是
的转化率先减小后增大的原因是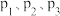 由大到小的顺序为
由大到小的顺序为
(3)已知图中
 点的温度和压强下,
点的温度和压强下, 的平衡转化率为
的平衡转化率为 ,测得此时水蒸气的浓度为
,测得此时水蒸气的浓度为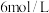 ,反应①的平衡常数为
,反应①的平衡常数为(4)工业上把生成的二甲醚用于制作燃料电池(如图),质子交换膜左右两侧溶液均为
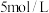 的
的 溶液。则电极
溶液。则电极 为
为 溶液的浓度
溶液的浓度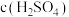
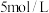 。
。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨工业 N2 (g)+3H2 (g)⇌2NH3 (g)在国民经济中占有重要地位,某温度下,向体积固定的1L密闭容器中充入1mol N2 (g)和3mol H2 (g),测得不同时刻反应前后的压强关系如表所示:
(1)0-15min 内,用H2表示的平均反应速率为 v(H2) =______ mol·L-1·min-1。
(2)达到平衡时N2的转化率为______ 。
(3)如图为不同条件下反应速率随时间的变化情况,则 a 时刻改变的条件可能是______ 。

(4)一定条件下的密闭容器中,该反应达到平衡后要提高 H2的转化率,可以采取的措施有______ 。
A.增加N2的浓度 B.加入催化剂 C.分离出 NH3 D.增加H2的浓度
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比值P 后/P 前 | 0.98 | 0.88 | 0.80 | 0.75 | 0.75 | 0.75 |
(2)达到平衡时N2的转化率为
(3)如图为不同条件下反应速率随时间的变化情况,则 a 时刻改变的条件可能是

(4)一定条件下的密闭容器中,该反应达到平衡后要提高 H2的转化率,可以采取的措施有
A.增加N2的浓度 B.加入催化剂 C.分离出 NH3 D.增加H2的浓度
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】乙二醛又名草酸醛,在医药、石化、轻工等方面有广泛的用途。
I.乙二醛可由乙醛硝酸氧化法制备.研究其他条件不变时,仅改变一个条件对乙二醛制备的影响,获得如下数据。
表格:其他条件相同时, 对反应的影响
对反应的影响
(1)补全乙醛硝酸氧化法制备乙二醛原理的方程式:______________ 。

(2)图1中曲线b对应的温度为______ ℃,该温度下, 内的平均反应速率约为
内的平均反应速率约为_____ mol/(L·h)(保留2位有效数字)。
(3)根据表格知,当反应中没有添加 时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:
时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:_________________ 。
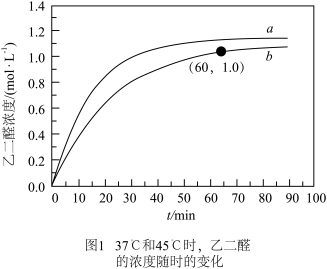
II.乙二醛制备乙醛酸( ),装置如图所示:
),装置如图所示:
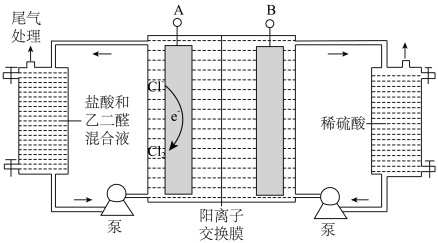
(4)与电源负极相连的是_______ (“A”或“B”)。
(5)结合化学用语解释制备乙醛酸的反应原理:_____ 。
(6)制得的乙醛酸溶液中通常含有乙二酸杂质,写出产生乙二酸的化学方程式:_________ 。
I.乙二醛可由乙醛硝酸氧化法制备.研究其他条件不变时,仅改变一个条件对乙二醛制备的影响,获得如下数据。

表格:其他条件相同时,
 对反应的影响
对反应的影响 用量(g) 用量(g) | 乙醛转化率(%) | 乙二醛 | |
| 选择性(%) | 收率(%) | ||
| 0.5 | 65.2 | 75.9 | 49.5 |
| 0.2 | 72.9 | 65.6 | 47.8 |
| 0.1 | 71.5 | 68.1 | 48.7 |
| 0 | 59.5 | 4.6 | 2.7 |
(1)补全乙醛硝酸氧化法制备乙二醛原理的方程式:

(2)图1中曲线b对应的温度为
 内的平均反应速率约为
内的平均反应速率约为(3)根据表格知,当反应中没有添加
 时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:
时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:II.乙二醛制备乙醛酸(
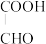 ),装置如图所示:
),装置如图所示:
(4)与电源负极相连的是
(5)结合化学用语解释制备乙醛酸的反应原理:
(6)制得的乙醛酸溶液中通常含有乙二酸杂质,写出产生乙二酸的化学方程式:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2 (g)+3H2 (g) CH3OH (g)+H2O (g) △H=-Q kJ/mol (Q>0)
CH3OH (g)+H2O (g) △H=-Q kJ/mol (Q>0)
(1)若在恒温恒容的容器内进行该反应,则可用来判断该反应达到平衡状态的标志有____ 。
A.容器内的压强保持不变
B.容器中CH3OH浓度与CO2浓度相等
C.容器中混合气体的密度保持不变
D.CO2的生成速率与H2O的生成速率相等
(2)某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
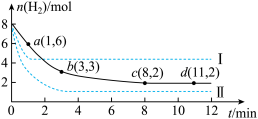
①该反应在0~8 min内CO2的平均反应速率是_____ mol/(L·min)。
②该反应的平衡常数表达式为_______ 。
③仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是____ ,曲线Ⅱ改变的条件可能是____ 。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是_________ 。
 CH3OH (g)+H2O (g) △H=-Q kJ/mol (Q>0)
CH3OH (g)+H2O (g) △H=-Q kJ/mol (Q>0)(1)若在恒温恒容的容器内进行该反应,则可用来判断该反应达到平衡状态的标志有
A.容器内的压强保持不变
B.容器中CH3OH浓度与CO2浓度相等
C.容器中混合气体的密度保持不变
D.CO2的生成速率与H2O的生成速率相等
(2)某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8 min内CO2的平均反应速率是
②该反应的平衡常数表达式为
③仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
您最近半年使用:0次
【推荐1】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: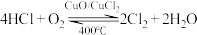
(1)已知400℃时:
ⅰ.断开1mol H—O键所需的能量比断开1molH—Cl键所需能量多akJ。
ⅱ.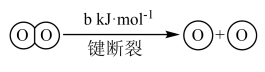
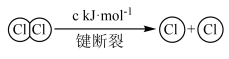
①写出此条件下,上述反应的热化学方程式________________ 。
②该反应能自发进行的主要原因是________________ 。
③下列有关地康法制取氯气说法正确的是( )
A.使用催化剂或开高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl)/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示:

①图中T1、T2的关系为:T1________ T2(填“>”、“<”或“=”)。
②图中纵坐标为物质________ 的转化率;
③若容器容积为2L,则B点的平衡常数的值为________ 。
④试画出温度T1时另一种反应物的转化率随氯氧比变化的图象________
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
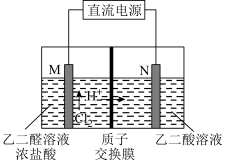
①写出乙二醛与M电极的产物反应生成乙醛酸的离子方程式________________ 。
②若有2mol H+通过质子交换膜,并完全参与反应,则该装置中生成的乙醛酸为________ mol。
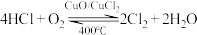
(1)已知400℃时:
ⅰ.断开1mol H—O键所需的能量比断开1molH—Cl键所需能量多akJ。
ⅱ.


①写出此条件下,上述反应的热化学方程式
②该反应能自发进行的主要原因是
③下列有关地康法制取氯气说法正确的是
A.使用催化剂或开高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
B.催化剂可以降低正逆反应的活化能,从而改变反应的焓变
C.选择温度为400℃,主要考虑此温度下催化剂活性高,反应速率快
D.达到化学平衡时,正反应和逆反应的速率相等且为零
(2)保持恒温恒容条件,将物质的量之和为5mol的HCl和O2以不同的氯氧比[n(HCl)/n(O2)]进行反应,平衡时某反应物的转化率与氯氧比及不同温度的关系如图所示:

①图中T1、T2的关系为:T1
②图中纵坐标为物质
③若容器容积为2L,则B点的平衡常数的值为
④试画出温度T1时另一种反应物的转化率随氯氧比变化的图象
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。

①写出乙二醛与M电极的产物反应生成乙醛酸的离子方程式
②若有2mol H+通过质子交换膜,并完全参与反应,则该装置中生成的乙醛酸为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】高温煤气脱硫是提高煤清洁转化利用效率的关键技术,效果较好的脱硫剂是铁酸锌(ZnFe2O4),部分反应如下:
Ⅰ.2FeS(s)+ZnS(s)+5O2(g)=ZnFe2O4(s)+3SO2(g) △H1=-1679.3kJ•mol-1
Ⅱ.2FeS(s)+ZnS(s)+10H2O(g)=ZnFe2O4(s)+3SO2(g)+10H2(g) △H2=+738.9kJ•mol-1
Ⅲ.2H2S(s)+3O2(g)=2SO2(g)+2H2O(g) △H3=-1172.0kJ•mol-1
回答下列问题:
(1)铁酸锌脱硫反应ZnFe2O4(s)+3H2S(g)+H2(g)=2FeS(s)+ZnS(s)+4H2O(g)的反应热△H=______ 。
(2)铁酸锌脱硫反应ZnFe2O4(s)+3H2S(g)+H2(g)=2FeS(s)+ZnS(s)+4H2O(g)经实验测定在不同投料比x1、x2、x3[投料比x= ]时H2S的平衡转化率与温度的关系如图所示。
]时H2S的平衡转化率与温度的关系如图所示。
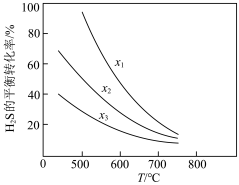
①x1、x2、x3由大到小的顺序是_____ 。
②一定温度下,向体积为5L的恒容密闭容器中投入3molH2S和2molH2和足量的ZnFe2O4时,初始压强为p0kPa,经4min反应达到平衡,测得平衡时H2O(g)的体积分数是氢气的2倍,则0~4min内的平均反应速率v(H2S)=______ 。该温度下,铁酸锌脱硫反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)一定温度(T0)下,在某恒容密闭容器中,按投料比n(H2S):n(O2)=2:3进行投料,发生反应2H2S(s)+3O2(g)=2SO2(g)+2H2O(g)。
①下列能够说明该反应已达到化学平衡状态的是______ (填标号)。
A.3v正(O2)=2v逆(SO2)
B.混合气体的密度不再变化
C.容器内气体总压强不再变化
D.混合气体的平均相对分子质量不再变化
②研究表明,该反应的反应速率方程式为v=k•cm(H2S)•c3(O2),其中k为速率常数,与温度、活化能有关.一定温度(T0)下,投料比n(H2S):n(O2)=2:3的初始反应速率为v0,当H2S转化率为50%时的反应速率为 v0,则反应速率方程式中m=
v0,则反应速率方程式中m=______ 。
(4)科学家制造出一种使用固体电解质的H2S燃料电池,固体电解质可以采用氧离子(O2-)导体或质子(H+)导体,电池反应原理如图所示。
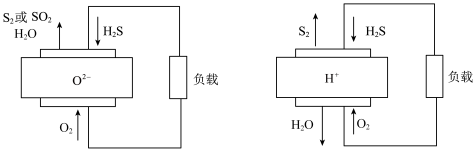
①固体电解质采用氧离子(O2-)导体时,负极产生SO2的电极反应式为______ 。
②固体电解质采用质子(H+)导体时,负极的电极反应式为_____ 。
Ⅰ.2FeS(s)+ZnS(s)+5O2(g)=ZnFe2O4(s)+3SO2(g) △H1=-1679.3kJ•mol-1
Ⅱ.2FeS(s)+ZnS(s)+10H2O(g)=ZnFe2O4(s)+3SO2(g)+10H2(g) △H2=+738.9kJ•mol-1
Ⅲ.2H2S(s)+3O2(g)=2SO2(g)+2H2O(g) △H3=-1172.0kJ•mol-1
回答下列问题:
(1)铁酸锌脱硫反应ZnFe2O4(s)+3H2S(g)+H2(g)=2FeS(s)+ZnS(s)+4H2O(g)的反应热△H=
(2)铁酸锌脱硫反应ZnFe2O4(s)+3H2S(g)+H2(g)=2FeS(s)+ZnS(s)+4H2O(g)经实验测定在不同投料比x1、x2、x3[投料比x=
 ]时H2S的平衡转化率与温度的关系如图所示。
]时H2S的平衡转化率与温度的关系如图所示。
①x1、x2、x3由大到小的顺序是
②一定温度下,向体积为5L的恒容密闭容器中投入3molH2S和2molH2和足量的ZnFe2O4时,初始压强为p0kPa,经4min反应达到平衡,测得平衡时H2O(g)的体积分数是氢气的2倍,则0~4min内的平均反应速率v(H2S)=
 总压
总压 物质的量分数)。
物质的量分数)。(3)一定温度(T0)下,在某恒容密闭容器中,按投料比n(H2S):n(O2)=2:3进行投料,发生反应2H2S(s)+3O2(g)=2SO2(g)+2H2O(g)。
①下列能够说明该反应已达到化学平衡状态的是
A.3v正(O2)=2v逆(SO2)
B.混合气体的密度不再变化
C.容器内气体总压强不再变化
D.混合气体的平均相对分子质量不再变化
②研究表明,该反应的反应速率方程式为v=k•cm(H2S)•c3(O2),其中k为速率常数,与温度、活化能有关.一定温度(T0)下,投料比n(H2S):n(O2)=2:3的初始反应速率为v0,当H2S转化率为50%时的反应速率为
 v0,则反应速率方程式中m=
v0,则反应速率方程式中m=(4)科学家制造出一种使用固体电解质的H2S燃料电池,固体电解质可以采用氧离子(O2-)导体或质子(H+)导体,电池反应原理如图所示。

①固体电解质采用氧离子(O2-)导体时,负极产生SO2的电极反应式为
②固体电解质采用质子(H+)导体时,负极的电极反应式为
您最近半年使用:0次
【推荐3】甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为:
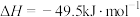
已知:①

②

计算反应②的
___________ 。
(2)对于反应 ,
,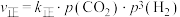 ,
,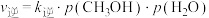 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下
分别为3∶1、1∶1、1∶3,得到不同压强条件下 的平衡转化率关系如图所示:
的平衡转化率关系如图所示:

①比较a、b、c各曲线所表示的投料比大小顺序为___________ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数
___________ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 ,
,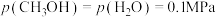 ,
, ,此时
,此时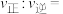
___________ 。
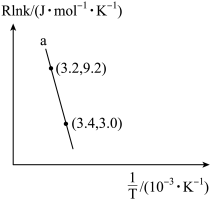
(3)甲醇催化可制取丙烯,反应为: ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为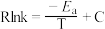 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①该反应的活化能
___________  。
。
②当使用更高效催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图___________ 。
(4)在饱和的 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 。其原理如图所示,则阴极的电极反应式为
。其原理如图所示,则阴极的电极反应式为___________ 。

(1)一种重要的工业制备甲醇的反应为:

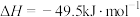
已知:①


②


计算反应②的

(2)对于反应
 ,
,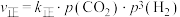 ,
,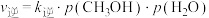 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下
分别为3∶1、1∶1、1∶3,得到不同压强条件下 的平衡转化率关系如图所示:
的平衡转化率关系如图所示:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数

③540K条件下,某容器测得某时刻
 ,
,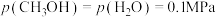 ,
, ,此时
,此时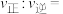
(3)甲醇催化可制取丙烯,反应为:
 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为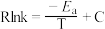 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。①该反应的活化能

 。
。②当使用更高效催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图
(4)在饱和的
 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 。其原理如图所示,则阴极的电极反应式为
。其原理如图所示,则阴极的电极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式__________ 。
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
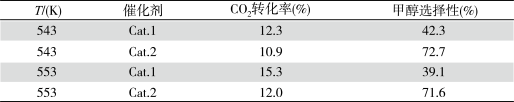
【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =________ kJ·mol-1。
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是________ 。
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是_____________ 。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______ 。电池的正极反应式:6O2+6e-=6O2-;6CO2+6O2-=3C2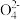 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是________ 。该电池的总反应式:__________ 。

(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1ⅠCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:
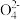 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】按要求完成下列填空。
(1)下列变化过程,属于化学反应且放热的是_______ 。
①浓 稀释②酸碱中和反应③Mg条与盐酸反应④
稀释②酸碱中和反应③Mg条与盐酸反应④ 与
与 ⑤铝热反应⑥碳高温条件下还原
⑤铝热反应⑥碳高温条件下还原 生成CO
生成CO
(2)以 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:

①上述过程①中,能量的变化形式是由_______ 转化为_______ 。
②写出 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式_______ 。
③CO和 作反应物的一种燃料电池,其构造如下图所示,Y为电池的
作反应物的一种燃料电池,其构造如下图所示,Y为电池的_______ (填“正”或“负”)极, 向
向_______ 极移动(填“X”或“Y”),负极电极反应式为_______ 。

(3)已知反应:
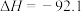 kJ/mol,在一定温度下,取1mol
kJ/mol,在一定温度下,取1mol 和3mol
和3mol 放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为_______ 。
(1)下列变化过程,属于化学反应且放热的是
①浓
 稀释②酸碱中和反应③Mg条与盐酸反应④
稀释②酸碱中和反应③Mg条与盐酸反应④ 与
与 ⑤铝热反应⑥碳高温条件下还原
⑤铝热反应⑥碳高温条件下还原 生成CO
生成CO(2)以
 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
①上述过程①中,能量的变化形式是由
②写出
 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式③CO和
 作反应物的一种燃料电池,其构造如下图所示,Y为电池的
作反应物的一种燃料电池,其构造如下图所示,Y为电池的 向
向
(3)已知反应:

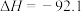 kJ/mol,在一定温度下,取1mol
kJ/mol,在一定温度下,取1mol 和3mol
和3mol 放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
放在1L密闭容器中,在催化剂条件下进行反应,测得平衡时反应放出的热量30.7kJ,则此温度下,该反应的平衡常数为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氮的氧化物既是常见的大气污染物,也是重要的化工原料,它们在工农业生产、生活中都发挥着重要作用。
(1)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知
 。该反应能自发进行的条件是
。该反应能自发进行的条件是___________ 。
(2)已知:

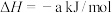

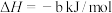

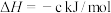
则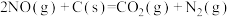

___________ kJ/mol。
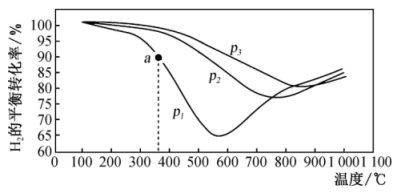
(3)在其他条件相同时,分别测得反应 中NO的平衡转化率在不同压强(
中NO的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图:
)下随温度变化的曲线如图:

则
___________  (填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为
(填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为 和
和 ,则
,则
___________  。
。
(4)在373K时,向体积为2L的恒容真空容器中通入0.40mol ,发生反应:
,发生反应:
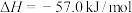 ;
; 的体积分数[
的体积分数[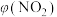 ]与反应时间(t)的关系如下表:
]与反应时间(t)的关系如下表:
①0~20min内,
___________ mol/L·min。
②上述反应中,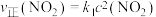 ,
, ,其中
,其中 、
、 为速率常数,则373K时
为速率常数,则373K时 、
、 的关系为
的关系为___________ (用含 、
、 式子表示)。
式子表示)。
(5) 催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:

 ,向容积为2L的恒容密闭容器中,充入
,向容积为2L的恒容密闭容器中,充入 和
和 的混合气体0.14mol充分反应。不同投料比[投料比
的混合气体0.14mol充分反应。不同投料比[投料比 ]时,
]时, 的平衡转化率与温度的关系如下图中曲线所示:
的平衡转化率与温度的关系如下图中曲线所示:

①x______ 3∶4(填“>”“<”或“=”,下同);投料比为3∶4时,Q点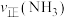
______ P点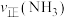 。
。
②利用反应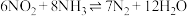 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出该电池的负极电极反应式:
构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出该电池的负极电极反应式:________ 。

(1)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知

 。该反应能自发进行的条件是
。该反应能自发进行的条件是(2)已知:

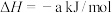

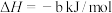

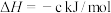
则
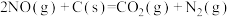

(3)在其他条件相同时,分别测得反应
 中NO的平衡转化率在不同压强(
中NO的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图:
)下随温度变化的曲线如图:
则

 (填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为
(填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为 和
和 ,则
,则
 。
。(4)在373K时,向体积为2L的恒容真空容器中通入0.40mol
 ,发生反应:
,发生反应:
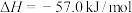 ;
; 的体积分数[
的体积分数[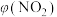 ]与反应时间(t)的关系如下表:
]与反应时间(t)的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 |
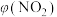 | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |

②上述反应中,
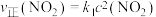 ,
, ,其中
,其中 、
、 为速率常数,则373K时
为速率常数,则373K时 、
、 的关系为
的关系为 、
、 式子表示)。
式子表示)。(5)
 催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:

 ,向容积为2L的恒容密闭容器中,充入
,向容积为2L的恒容密闭容器中,充入 和
和 的混合气体0.14mol充分反应。不同投料比[投料比
的混合气体0.14mol充分反应。不同投料比[投料比 ]时,
]时, 的平衡转化率与温度的关系如下图中曲线所示:
的平衡转化率与温度的关系如下图中曲线所示:
①x
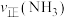
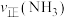 。
。②利用反应
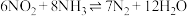 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出该电池的负极电极反应式:
构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出该电池的负极电极反应式:
您最近半年使用:0次



