常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:
请回答下列问题:
(1)上述六种溶液中的阴离子,结合H+能力最强的是____________ (填离子符号)。
(2)上述六种溶液中,水的电离程度最小的是____________ (填化学式)。
(3)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是________ 、________ (每空填写一种物质)。
(4)依据复分解反应的规律,判断下列反应不能进行的是________ 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaCN=Na2CO3+2HCN
(5)将CO2气体通入饱和碳酸钠溶液中,可以观察到的现象是_______ ,原因为_________ (用离子方程式表示)。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中的阴离子,结合H+能力最强的是
(2)上述六种溶液中,水的电离程度最小的是
(3)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是
(4)依据复分解反应的规律,判断下列反应不能进行的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaCN=Na2CO3+2HCN
(5)将CO2气体通入饱和碳酸钠溶液中,可以观察到的现象是
更新时间:2020-02-15 04:54:55
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】已知水在25℃和95℃时的水的离子积常数分别为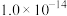 、
、 。
。
(1)25℃, 的
的 溶液在加水稀释过程中,下列表达式的数据变大的是_______(填字母序号,下同)。
溶液在加水稀释过程中,下列表达式的数据变大的是_______(填字母序号,下同)。
(2)95℃时,若1体积pH=a的某二元强酸溶液与100体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_______ 。
(3)25℃时,将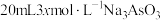 、
、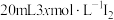 和20mLNaOH溶液混合,发生反应:
和20mLNaOH溶液混合,发生反应: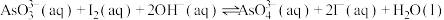 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是_______ (填字母)。
A.溶液的pH不再变化 B.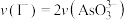
C.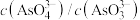 不再变化 D.
不再变化 D.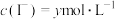
②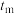 时,
时,
_______ 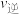 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
③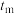 时,
时,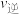
_______ 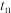 时
时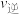 (填“大于”“小于”或“等于”),理由是
(填“大于”“小于”或“等于”),理由是_______ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。(用含x、y的代数式表示)
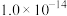 、
、 。
。(1)25℃,
 的
的 溶液在加水稀释过程中,下列表达式的数据变大的是_______(填字母序号,下同)。
溶液在加水稀释过程中,下列表达式的数据变大的是_______(填字母序号,下同)。A. | B. |
C.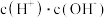 | D.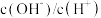 |
(3)25℃时,将
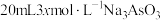 、
、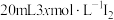 和20mLNaOH溶液混合,发生反应:
和20mLNaOH溶液混合,发生反应: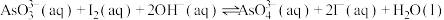 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
A.溶液的pH不再变化 B.
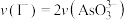
C.
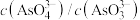 不再变化 D.
不再变化 D.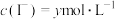
②
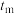 时,
时,
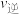 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。③
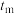 时,
时,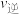
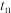 时
时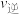 (填“大于”“小于”或“等于”),理由是
(填“大于”“小于”或“等于”),理由是④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】如表是几种常见弱酸的电离平衡常数(25℃)。
(1) 当温度升高时,K值_____ (填“增大”“减小”或“不变”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是_____ ,最弱的是_____ 。由离子反应规律及上述数据判断,下列各组物质在溶液中混合后能发生反应的有_____ (填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由_______ 决定。假设某氢硫酸溶液的浓度为0.001 3 mol·L-1,则溶液中c(H+)=______ 。
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是____ ,反应的化学方程式为_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3- | K1=4.4×10-7 |
HCO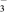  H++CO32- H++CO32- | K2=4.7×10-11 | |
| H2S | H2S H++HS- H++HS- | K1=1.3×10-7 |
HS- H++S2- H++S2- | K2=7.1×10-15 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4- | K1=7.1×10-3 |
H2PO4- H++HPO42- H++HPO42- | K2=6.3×10-8 | |
HPO42- H++PO43- H++PO43- | K3=4.2×10-13 |
(1) 当温度升高时,K值
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:


(1)下列有关氢氟酸性质中可以证明它是弱电解质的是________________
A. 常温下0.1mol/L的氢氟酸溶液pH约为2
B. 氢氟酸溶液能使紫色石蕊溶液变红
C. 10mL 1mol/L 氢氟酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 某氢氟酸溶液与金属镁反应的速率比较慢
E. 相同条件下氢氟酸溶液的导电能力比盐酸的弱
(2)NaF是一种农业杀虫剂,溶液中四种离子浓度大小关系为___________________
(3)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,分别得到溶液1和溶液2,实验测产生的气体体积(V)随时间(t)变化如图2所示,曲线a反映的是________________ (填“CH3COOH”或“HSCN”)与NaHCO3反映产生气体的变化情况,反应结束后所得两溶液中,c(OH-)溶液1_______ c(OH-)溶液2(填“>”、“<”或“=”)
(4)CaF2俗名萤石,难溶于水,若将4.0×10-3mol/L HF溶液与2.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),判断此时溶液中是否有CaF2沉淀生成并说明理由______
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:


(1)下列有关氢氟酸性质中可以证明它是弱电解质的是
A. 常温下0.1mol/L的氢氟酸溶液pH约为2
B. 氢氟酸溶液能使紫色石蕊溶液变红
C. 10mL 1mol/L 氢氟酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 某氢氟酸溶液与金属镁反应的速率比较慢
E. 相同条件下氢氟酸溶液的导电能力比盐酸的弱
(2)NaF是一种农业杀虫剂,溶液中四种离子浓度大小关系为
(3)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,分别得到溶液1和溶液2,实验测产生的气体体积(V)随时间(t)变化如图2所示,曲线a反映的是
(4)CaF2俗名萤石,难溶于水,若将4.0×10-3mol/L HF溶液与2.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),判断此时溶液中是否有CaF2沉淀生成并说明理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______ (填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______ 。
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN ),下列关系正确的是
),下列关系正确的是_______ 。
a.c(H+)>c(OH ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(4)某温度下纯水的c(H+)=4.0×10 mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10 mol/L,则此溶液中由水电离产生的c(H+)=
mol/L,则此溶液中由水电离产生的c(H+)=_______ 。
(5)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10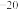 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>_______
(6)在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式_______ 。(Ksp(FeS)=6.3×10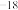 ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10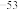 )
)
| 醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 Ka2=5.6×10  | Ka=6.2×10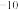 |
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN
 ),下列关系正确的是
),下列关系正确的是a.c(H+)>c(OH
 ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN )=0.01mol/L
)=0.01mol/LII.请用有关电解质溶液的知识回答下列问题:
(4)某温度下纯水的c(H+)=4.0×10
 mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10 mol/L,则此溶液中由水电离产生的c(H+)=
mol/L,则此溶液中由水电离产生的c(H+)=(5)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10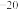 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>(6)在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式
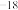 ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10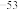 )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】红矾钠 ( )可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
)可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。

已知:i.Cr(Ⅵ)溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
(1)Ⅰ中, 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:___________
(2)Ⅱ中,加入 调节
调节 至
至___________ (填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中, 氧化
氧化 沉淀的化学方程式为:
沉淀的化学方程式为:___________
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高, 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是___________
(5)Ⅳ中,加入 的作用是
的作用是___________ (结合平衡移动原理解释)。
(6)为了测定获得红矾钠( )的纯度,称取上述流程中的产品a g配成
)的纯度,称取上述流程中的产品a g配成 溶液,取出25mL放于锥形㼛中,加入稀硫酸和足量的
溶液,取出25mL放于锥形㼛中,加入稀硫酸和足量的 溶液,置于暗处充分反应至
溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为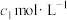 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗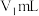 。(已知:
。(已知: )
)
①滴定终点的现象为___________
②所得 (摩尔质量为
(摩尔质量为 )的纯度的表达式为:
)的纯度的表达式为:___________ (用质量分数表示)。
(7)常温下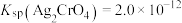 、
、 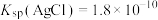 ,在化学分析中,以
,在化学分析中,以 标准液滴定溶液中的
标准液滴定溶液中的 时,可以采用上述步骤Ⅲ制得的
时,可以采用上述步骤Ⅲ制得的 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择
反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择 作为指示剂的原因:
作为指示剂的原因:
当溶液中 恰好沉淀完全时,此时溶液中
恰好沉淀完全时,此时溶液中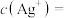
___________  ,
,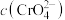 需达到
需达到___________  可以出现砖红色沉淀。
可以出现砖红色沉淀。
 )可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
)可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.Cr(Ⅵ)溶液中存在以下平衡:

ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:(2)Ⅱ中,加入
 调节
调节 至
至a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,
 氧化
氧化 沉淀的化学方程式为:
沉淀的化学方程式为:(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,
 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)Ⅳ中,加入
 的作用是
的作用是(6)为了测定获得红矾钠(
 )的纯度,称取上述流程中的产品a g配成
)的纯度,称取上述流程中的产品a g配成 溶液,取出25mL放于锥形㼛中,加入稀硫酸和足量的
溶液,取出25mL放于锥形㼛中,加入稀硫酸和足量的 溶液,置于暗处充分反应至
溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为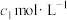 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗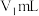 。(已知:
。(已知: )
)①滴定终点的现象为
②所得
 (摩尔质量为
(摩尔质量为 )的纯度的表达式为:
)的纯度的表达式为:(7)常温下
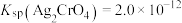 、
、 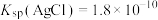 ,在化学分析中,以
,在化学分析中,以 标准液滴定溶液中的
标准液滴定溶液中的 时,可以采用上述步骤Ⅲ制得的
时,可以采用上述步骤Ⅲ制得的 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择
反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择 作为指示剂的原因:
作为指示剂的原因:当溶液中
 恰好沉淀完全时,此时溶液中
恰好沉淀完全时,此时溶液中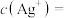
 ,
,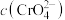 需达到
需达到 可以出现砖红色沉淀。
可以出现砖红色沉淀。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】维持 的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系 的变化如表所示。
的变化如表所示。
①
_____ (忽略通入 气体前后体系的体积变化)。
气体前后体系的体积变化)。
②结合化学用语解释试剂ⅱ显酸性的原因:_____ 。
③试剂ⅱ中微粒浓度关系正确的有_____ (填序号)。
A.
B.
C.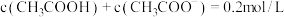
④由表中数据可知,试剂ⅱ的 受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的
受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的 几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是
几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是_____ (填序号)。
A. B.
B.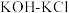 C.
C.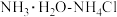 D.
D.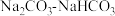
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如图所示,电池的总反应如下:

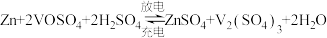
已知: 和
和 的电离方程式分别为:
的电离方程式分别为:
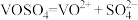
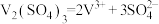
①放电时,电子的流向是___________ (填“锌→石墨”或“石墨→锌”); 向
向___________ (填“A室”或“B室”)移动。
②放电时B室的电极反应式是_____ 。
③充电时,A室中的 变化缓慢的原因是
变化缓慢的原因是___________ 。
 的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。(1)常温下,在不同试剂中加入酸或碱后体系
 的变化如表所示。
的变化如表所示。| 试剂 |  | ||
| 初始 | 通入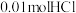 气体 气体 | 加入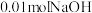 固体 固体 | |
ⅰ.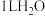 | 7 |  | 12 |
ⅱ. 、 、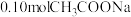 配制成 配制成 的溶液 的溶液 | 4.76 | 4.67 | 4.85 |
①

 气体前后体系的体积变化)。
气体前后体系的体积变化)。②结合化学用语解释试剂ⅱ显酸性的原因:
③试剂ⅱ中微粒浓度关系正确的有
A.

B.

C.
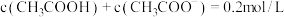
④由表中数据可知,试剂ⅱ的
 受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的
受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的 几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是
几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是A.
 B.
B.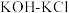 C.
C.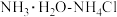 D.
D.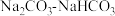
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如图所示,电池的总反应如下:

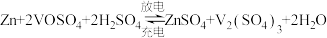
已知:
 和
和 的电离方程式分别为:
的电离方程式分别为: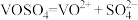
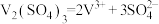
①放电时,电子的流向是
 向
向②放电时B室的电极反应式是
③充电时,A室中的
 变化缓慢的原因是
变化缓慢的原因是
您最近一年使用:0次



