氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___ ,B、C、N、O第一电离能由大到小的顺序为___ ,CH4、H2O、CO2的键角按照由大到小的顺序排列为___ 。
(2)与(HB=NH)3互为等电子体的有机分子为___ (填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
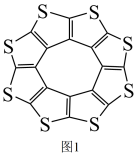
①C16S8分子中C原子和S原子的杂化轨道类型分别为___ 。
②相关键长数据如表所示:
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___ 。
③C16S8与H2微粒间的作用力是___ 。
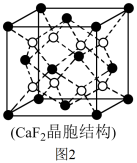
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___ 。
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___ cm3(用含a、NA的代数式表示,NA表示阿伏加 德罗常数的值)。

Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为
(2)与(HB=NH)3互为等电子体的有机分子为
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。

①C16S8分子中C原子和S原子的杂化轨道类型分别为
②相关键长数据如表所示:
| 化学键 | C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是
③C16S8与H2微粒间的作用力是
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为

(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为

更新时间:2020-03-16 15:50:29
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】在超分子化学中,常用Cu+模板合成各种拓扑结构分子,如图为诺贝尔得主auvage教授利用亚铜离子为模板合成的索烃结构。回答下列问题:
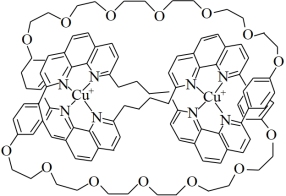
(1)基态Cu+的核外价电子轨道表示式为____ ,固态时Cu+比Cu2+稳定的原因是____ 。
(2)该索烃中同周期非金属元素第一电离能由大到小的顺序是____ 。
(3)索烃中碳原子的杂化类型为____ ,1mol索烃中所含的配位键的物质的量为____ 。
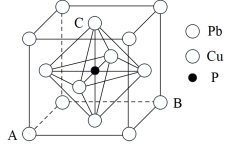
(4)铅磷青铜具有很高的耐腐蚀性和耐磨性,常用于制作耐磨零件和滑动轴承。如图为铅磷青铜的一种晶胞结构,该晶胞的化学式为____ ;已知A点原子的分数坐标为(0,0,0),B点原子的分数坐标为(1,1,0)则C点原子的分数坐标应为____ ;已知晶体的密度为8.85g·cm-3,则晶胞参数为____ pm(用含有NA的代数式表达)。

(1)基态Cu+的核外价电子轨道表示式为
(2)该索烃中同周期非金属元素第一电离能由大到小的顺序是
(3)索烃中碳原子的杂化类型为
(4)铅磷青铜具有很高的耐腐蚀性和耐磨性,常用于制作耐磨零件和滑动轴承。如图为铅磷青铜的一种晶胞结构,该晶胞的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__ (填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____ 种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________ 。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____ 。1 mol HCHO分子中含有σ键的物质的量为____ mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__ 。与H2O分子互为等电子体的阴离子为__ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______ 。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________ 。
(2)元素B、C、D的第一电离能由小到大排列顺序为________ 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________ 。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________ 。
(1)下列微粒基态的电子排布中未成对电子数最多的是
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O
 [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN①Zn2+基态核外电子排布式为
②HOCH2CN分子中碳原子轨道的杂化类型是
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为
(2)元素B、C、D的第一电离能由小到大排列顺序为
(3)D元素原子的最外层电子轨道表示式为
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】第四周期的钒、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钒的基态原子的价层电子排布式为___ ;钒在周期表中的位置为___ 。
(2)V2O5是一种常见的催化剂,在合成硫酸、硝酸中起到非常重要的作用。
①五氧化二钒的结构简式为( ),则该结构中σ键与π键个数之比为
),则该结构中σ键与π键个数之比为___ 。
②V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。VO 与PO
与PO 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为___ ,再写出一种空间构型与之相同的阳离子___ (填离子符号)。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____ (填“<”、“=”或“>”)FeO。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图所示。下列说法正确的是___ (填字母序号)。

A.该复合物中只含有离子键和配位键
B.该复合物中Cl原子的价层电子对数为4
C.该复合物中只有CO和H2O作为配位体
D.CO与N2互为等电子体,其结构为C≡O
(5)已知单质钒的晶胞结构如图所示,假设晶胞的棱长为anm,密度为ρg•cm-3,则钒的相对原子质量为___ 。(设阿伏加德罗常数的值为NA)

(1)钒的基态原子的价层电子排布式为
(2)V2O5是一种常见的催化剂,在合成硫酸、硝酸中起到非常重要的作用。
①五氧化二钒的结构简式为(
 ),则该结构中σ键与π键个数之比为
),则该结构中σ键与π键个数之比为②V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。VO
 与PO
与PO 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图所示。下列说法正确的是

A.该复合物中只含有离子键和配位键
B.该复合物中Cl原子的价层电子对数为4
C.该复合物中只有CO和H2O作为配位体
D.CO与N2互为等电子体,其结构为C≡O
(5)已知单质钒的晶胞结构如图所示,假设晶胞的棱长为anm,密度为ρg•cm-3,则钒的相对原子质量为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。Zn2+的价层电子排布式是_______ , 中的磷原子的杂化轨道类型是
中的磷原子的杂化轨道类型是_______ , 离子的立体构型是
离子的立体构型是_______ 。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)_______ I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,原因是_______ (用离子方程式表示)。
(4)锌锰干电池中Zn2+可吸收电池反应产生的NH3生成[Zn(NH3)4]2+,1个该离子中含有_______ 个σ键。
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为_______ ,其结构单元棱长为apm,底面边长为bpm,该合金的密度为_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。Zn2+的价层电子排布式是
 中的磷原子的杂化轨道类型是
中的磷原子的杂化轨道类型是 离子的立体构型是
离子的立体构型是(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)
(3)新制的Cu(OH)2能够溶解于浓氨水中,原因是
(4)锌锰干电池中Zn2+可吸收电池反应产生的NH3生成[Zn(NH3)4]2+,1个该离子中含有
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】随着科学的发展,氟及其化合物的用途日益广泛。
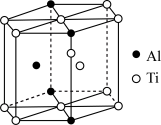
Ⅰ、离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
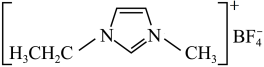
1−乙基−3−甲基咪唑四氟硼酸盐( )
)
(1)写出基态铜原子的价电子排布式___________ 。
(2) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中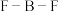 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
(3)以 和
和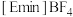 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为___________ ,电解质溶液中 向
向___________ 极移动(填“阴”或“阳”)。
Ⅱ、 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个。
(5) 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
Ⅰ、离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

1−乙基−3−甲基咪唑四氟硼酸盐(
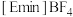 )
)(1)写出基态铜原子的价电子排布式
(2)
 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中
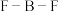 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与
可以与 反应生成
反应生成 的原因是
的原因是(3)以
 和
和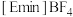 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ、
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有(5)
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】“掺杂”和“包覆”是改善电极性能的重要手段。工业上以Li2CO3为原料制备锂离子电池的正极材料NCM811(LiNi0.8Co0.1Mn0.1O2)。
回答下列问题:
(1)基态氧原子价电子轨道表示式为___ ;Mn属于__ 区元素;基态Co原子核外电子有__ 种运动状态。
(2)与Li2CO3的阴离子互为等电子体的分子有__ (填化学式);Li2CO3阴离子的中心原子采取了__ 杂化方式,Li2CO3热稳定性__ (填“>”或“<”)其同族其他元素的碳酸盐。
(3)“掺杂”能够提高电极的电导率和结构稳定性。MgF2是常用的掺杂剂,其熔点高于MgCl2熔点的原因为___ 。
(4)TiO2形成的表面包覆材料,能够明显提高NCM811的性能。已知:NA为阿伏加德罗常数的值。TiO2的晶胞如图所示(α=β=γ=90°)。TiO2晶体中O原子的配位数为__ ,TiO2晶胞的密度为__ g•cm-3(用含NA、a和b的式子表示)。

回答下列问题:
(1)基态氧原子价电子轨道表示式为
(2)与Li2CO3的阴离子互为等电子体的分子有
(3)“掺杂”能够提高电极的电导率和结构稳定性。MgF2是常用的掺杂剂,其熔点高于MgCl2熔点的原因为
(4)TiO2形成的表面包覆材料,能够明显提高NCM811的性能。已知:NA为阿伏加德罗常数的值。TiO2的晶胞如图所示(α=β=γ=90°)。TiO2晶体中O原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】开发新型储氢材料是氢能利用的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键_______ (填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为_______ ,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为_______ 。
②与(HB=NH)3互为等电子体的分子为_______ (填分子式)。
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为_______ 。
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为_______ ,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为_______ 。

(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为_______ 。
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是_______ 。
③铜的单质中按ABCABC⋯方式堆积,设铜原子半径为apm,则该晶体的密度为_______ g/cm3(阿伏加德罗常数值为NA)
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键
②与(HB=NH)3互为等电子体的分子为
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为

(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是
③铜的单质中按ABCABC⋯方式堆积,设铜原子半径为apm,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硼元素为绿色植物或藻类生长的必需元素。回答下列问题:
(1)基态硼原子核外电子排布式可表示为__________________ 。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的__________________ 。
(3)将少量BF3通入水中时,得到四氟硼酸(HBF4)溶液,同时有硼酸生成。四氟硼酸为无色透明液体,呈强酸性,用于金属表面氧化物、硅酸盐膜的清洁和腐蚀剂。
①BF 离子中B原子的杂化方式为
离子中B原子的杂化方式为___________ 。
②硼酸晶体[H3BO3或B(OH)3]的片层结构如下图所示,其在冷水中溶解度低,而在热水中增加,原因是______________________ 。
③硼酸溶液中,存在[B(OH)4]-离子,该离子中含有的化学键为_____________ 。
A.离子键 B.共价键 C.金属键 D.配位键

(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,结构之一为立方氮化硼,如图所示。
①图中氮原子的配位数为________ ,离硼原子最近且等距离的硼原子有______ 个。
②已知立方氮化硼晶胞中B与N之间的距离为a nm,则晶胞边长___________ pm。
(1)基态硼原子核外电子排布式可表示为
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的
(3)将少量BF3通入水中时,得到四氟硼酸(HBF4)溶液,同时有硼酸生成。四氟硼酸为无色透明液体,呈强酸性,用于金属表面氧化物、硅酸盐膜的清洁和腐蚀剂。
①BF
 离子中B原子的杂化方式为
离子中B原子的杂化方式为②硼酸晶体[H3BO3或B(OH)3]的片层结构如下图所示,其在冷水中溶解度低,而在热水中增加,原因是
③硼酸溶液中,存在[B(OH)4]-离子,该离子中含有的化学键为
A.离子键 B.共价键 C.金属键 D.配位键

(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,结构之一为立方氮化硼,如图所示。
①图中氮原子的配位数为
②已知立方氮化硼晶胞中B与N之间的距离为a nm,则晶胞边长
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】尿素[CO(NH2)2]合成方法的发展体现了化学科学与技术的不断进步。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为___________ ,尿素中碳原子的杂化轨道类型为___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。
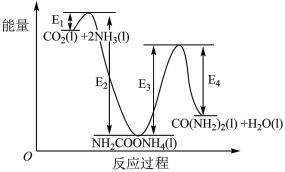
结合反应过程中能量变化示意图,下列说法正确的是___________ (填字母)。
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。

①电解池中电极X应接直流电源的___________ 极。
②电解过程中生成尿素的电极反应式是___________ 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c( )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
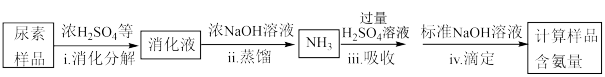
①消化液中的含氮粒子是___________ 。
②下列装置,可以完成蒸馏操作的是___________ (填字母)。
A. B.
B.  C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。
(1)德国化学家韦勒(F. Wohler)首次在实验室里用无机物合成了尿素[CO(NH2)2],打破了无机物和有机物之间的界限。尿素分子中σ键和π键个数之比为
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分为两步:ⅰ.CO2和NH3生成H2NCOONH4;ⅱ。H2NCOONH4分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应ⅰ<反应ⅱ
b.CO2(l) +2NH3(l)= H2NCOONH4(l) △H=+(E2-E1)kJ/mol
c. H2NCOONH4(l)=CO(NH2)2(l)+ H2O(1) △H=+(E3- E4)kJ/mol
d.对反应体系加热,可加快反应速率和提高尿素的产率
(3)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通入CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示(阴、阳极区溶液均为KNO3溶液)。
①电解池中电极X应接直流电源的
②电解过程中生成尿素的电极反应式是
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c(
 )不能直接用NaOH溶液准确滴定。
)不能直接用NaOH溶液准确滴定。
①消化液中的含氮粒子是
②下列装置,可以完成蒸馏操作的是
A.
 B.
B.  C.
C. D.
D. 
③步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】阳极泥富集了矿石、精矿或熔剂中大部分的贵金属元素,因而具有很高的综合回收价值。从某阳极泥(主要成分有Cu、Ag、Au、Ag₂Se、Cu₂S和NiSO₄等)中回收Se和部分金属的工艺流程如图所示。 。
。
② ,相同条件下,
,相同条件下, 与
与 的氧化性相近。
的氧化性相近。
(1)“焙烧”产生的 与
与 的混合烟气用水吸收可制得单质Se,该反应的化学方程式为
的混合烟气用水吸收可制得单质Se,该反应的化学方程式为___________ 。
(2)“酸浸氧化”中通入氧气的目的是___________ ;“反萃取剂”选用___________ (填化学式)溶液。
(3)沉银时加入NaCl,可将 转化为AgCl,再用硫代硫酸盐溶液浸出银元素。
转化为AgCl,再用硫代硫酸盐溶液浸出银元素。
已知:①
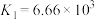
②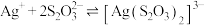
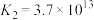
若所得浸出液中 mol⋅L
mol⋅L ,则溶液中
,则溶液中
___________ mol⋅L 。
。
(4)浸出Au的离子方程式为___________ 。
(5) 是一种窄能带半导体材料,具有良好的光电、热电性能,其晶胞结构如图所示。
是一种窄能带半导体材料,具有良好的光电、热电性能,其晶胞结构如图所示。 ,则晶胞中B处原子分数坐标为
,则晶胞中B处原子分数坐标为___________ 。若晶胞参数a nm, 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为___________ g·cm 。
。

 。
。②
 ,相同条件下,
,相同条件下, 与
与 的氧化性相近。
的氧化性相近。(1)“焙烧”产生的
 与
与 的混合烟气用水吸收可制得单质Se,该反应的化学方程式为
的混合烟气用水吸收可制得单质Se,该反应的化学方程式为(2)“酸浸氧化”中通入氧气的目的是
(3)沉银时加入NaCl,可将
 转化为AgCl,再用硫代硫酸盐溶液浸出银元素。
转化为AgCl,再用硫代硫酸盐溶液浸出银元素。已知:①

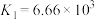
②
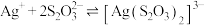
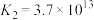
若所得浸出液中
 mol⋅L
mol⋅L ,则溶液中
,则溶液中
 。
。(4)浸出Au的离子方程式为
(5)
 是一种窄能带半导体材料,具有良好的光电、热电性能,其晶胞结构如图所示。
是一种窄能带半导体材料,具有良好的光电、热电性能,其晶胞结构如图所示。
 ,则晶胞中B处原子分数坐标为
,则晶胞中B处原子分数坐标为 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硅烷 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下:
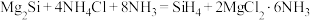
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)O、N、H的电负性由大到小的顺序是___________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是___________ (填序号)。
a.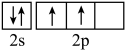 b.
b.  c.
c.
(4)① 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
② 中H—Si—H的键角
中H—Si—H的键角___________  中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(5) 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是___________ 。

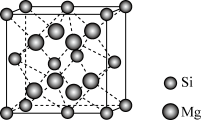
(6) 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________ 个紧邻的Mg原子。已知 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下: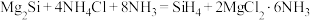
(1)硅在元素周期表中的位置是
(2)O、N、H的电负性由大到小的顺序是
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是
a.
 b.
b.  c.
c.
(4)①
 的沸点比
的沸点比 的
的②
 中H—Si—H的键角
中H—Si—H的键角 中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是(5)
 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
(6)
 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
【推荐3】不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,回答下列相关问题:
(1)基态碳原子的核外电子轨道表示式为_______ 。
(2)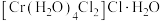 中Cr的配位数为
中Cr的配位数为_______ 。
(3)铁在元素周期表中的位置是_______ ,铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用_______ 摄取铁元素的原子光谱。
(4)与铁属于同一周期,且未成对价电子数最多的元素的是_______ (填元素符号)。
(5)Fe、Sr、O可形成两种晶体,晶胞结构如图所示,已知NA为阿伏加德罗常数,图甲、图乙表示的晶胞均为立方晶胞。

①图甲晶胞化学式是_______ 。
②图乙所示晶胞密度为d g/cm3,则该晶胞的边长为_______ nm(用含NA的式子表示)
(1)基态碳原子的核外电子轨道表示式为
(2)
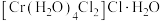 中Cr的配位数为
中Cr的配位数为(3)铁在元素周期表中的位置是
(4)与铁属于同一周期,且未成对价电子数最多的元素的是
(5)Fe、Sr、O可形成两种晶体,晶胞结构如图所示,已知NA为阿伏加德罗常数,图甲、图乙表示的晶胞均为立方晶胞。

①图甲晶胞化学式是
②图乙所示晶胞密度为d g/cm3,则该晶胞的边长为
您最近一年使用:0次



