室温下,下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) |
| B.0.1mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.2 mol/L |
| C.浓度均为0.1 mol/L的 ① NH4Cl ②NH4Al(SO4)2 ③ NH4HCO3三种溶液,其中c(NH4+):②>①>③ |
| D.pH=11的NaOH溶液与pH =3的CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
更新时间:2020-03-27 15:55:20
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】设NA为阿伏加德罗常数的值,下列说法正确的是
| A.28g乙烯中含有共用电子对的数目为5NA |
B.标准状况下,2.24LNO与1.12L 反应后分子总数小于0.1NA 反应后分子总数小于0.1NA |
C.将1mol 溶于稀氨水中使溶液呈中性,则溶液中 溶于稀氨水中使溶液呈中性,则溶液中 的数目大于NA 的数目大于NA |
D.向沸水中滴加10mL 溶液,制得 溶液,制得 胶体微粒的数目大于0.01NA 胶体微粒的数目大于0.01NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】设NA为阿伏加德罗常数的值,下列叙述错误的是
A.向1 L 0.1 mol/L NH4Cl溶液中滴加NaOH溶液至中性,所得溶液中 数小于0.1NA 数小于0.1NA |
| B.10 g 92%的乙醇溶液与足量金属钠充分反应,产生的H2分子数为0.1NA |
C.0.1 mol 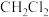 所含价电子总数为2NA 所含价电子总数为2NA |
| D.0.1 mol苯乙烯中sp2杂化的碳原子个数为0.8NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列溶液中有关粒子的物质的量浓度关系正确的是
| A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) |
| B.25℃时,pH=12的NaOH溶液与pH=12的氨水:c (Na+ ) = c(NH4+ ) |
| C.pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (H2A) > c (A2- ) |
| D.在K2CO3溶液中:c (CO32- ) + c (OH- ) = c (HCO3- ) + c( H+ ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。下列说法错误的是
已知:缓冲作用是维持溶液自身pH值的相对稳定。
| 试剂 | pH | ||
| 初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
| ①1LH2O | 7 | a | 12 |
| ②0.10molCH3COOH,0.10molCH3COONa配制成1L的溶液 | 4.76 | 4.67 | 4.85 |
| A.表中a的数值等于2(忽略通入HCl气体前后体系的体积变化) |
| B.试剂①如表所示通入HCl和加入NaOH相比,水的电离程度相同 |
| C.试剂②中c(CH3COOH)>c(Na+)>c(CH3COO-) |
| D.NH3·H2O—NH4Cl溶液具有与试剂②相似的缓冲作用 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,向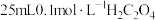 溶液中滴加
溶液中滴加 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布系数
的分布系数 随
随 的变化如图所示(忽略反应过程中温度变化)。已知:
的变化如图所示(忽略反应过程中温度变化)。已知: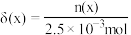 常温下,
常温下,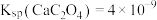 。下列说法错误的是
。下列说法错误的是
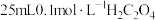 溶液中滴加
溶液中滴加 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布系数
的分布系数 随
随 的变化如图所示(忽略反应过程中温度变化)。已知:
的变化如图所示(忽略反应过程中温度变化)。已知: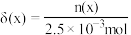 常温下,
常温下,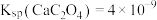 。下列说法错误的是
。下列说法错误的是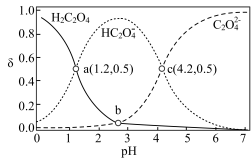
A.常温下,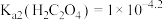 |
B.b、c点对应的溶液中均存在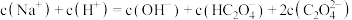 |
C. 时, 时,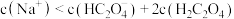 |
D.若等浓度、等体积的 溶液与 溶液与 溶液混合后产生沉淀,则上层清液中 溶液混合后产生沉淀,则上层清液中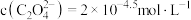 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】向20 mL0.5 mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
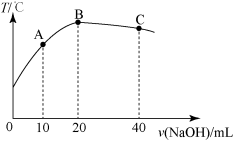
| A.醋酸的电离平衡常数:B点<A点 |
| B.由水电离出的c(OH-):B点>C点 |
| C.从A点到B点,混合溶液中不可能存在:c(CH3COO-)=c(Na+) |
| D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
您最近一年使用:0次



