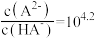常温下,向20mL0.1mol•L-1NH4HSO4溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )

| A.c点之前,主要的反应为NH4++OH-═NH3•H2O |
| B.b点和d点对应溶液的pH均为7 |
| C.常温下,Kb(NH3•H2O)=5×10-5.4mol•L-1 |
| D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-) |
更新时间:2020-04-03 14:13:03
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】某温度下重水中存在电离平衡D2O  D+ + OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是
D+ + OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是
 D+ + OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是
D+ + OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是| A.0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B.将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C.向30mL0.5mol·L-1NaOD的重水溶液中加入20mL0.5mol·L-1DCl的重水溶液,所得溶液pD=13 |
| D.pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol·L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
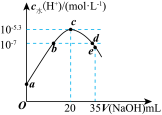
【推荐2】常温下,向20 mL0.1 mol. L-1HN3(叠氮酸)溶液中滴加pH=13的NaOH溶液,溶液中水电离的c(H+)与NaOH溶液体积的关系如图所示(电离度等于已电离的电解质浓度与电解质总浓度之比)。下列说法错误的是


| A.HN3是一元弱酸 |
| B.c点溶液中:c(OH-) =c(H+) +c( HN3) |
| C.常温下,b、d点溶液都显中性 |
| D.常温下,0.1 mol. L-1 HN3溶液中HN3的电离度为10a-11 % |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】25℃时,向20 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,溶液的pH与所加NaOH溶液体积的关系如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确 的是
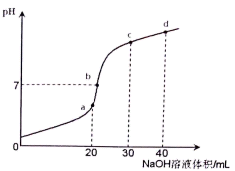

| A.在a→d的过程中,a点的溶液中水的电离程度最大 |
| B.在b点的溶液中,c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C.在c点的溶液中,c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-) |
| D.在c→d的过程中,溶液中c(NH4+)+c(NH3·H2O)+c(Na+)=0.1 mol/L始终成立 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,向盛有60mL pH=4 HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示。下列叙述不正确的是( )


| A.HA溶液的物质的量浓度为0.067mol·L-1 |
| B.25℃时,HA的电离平衡常数约为1.5×10-9 |
| C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) |
| D.b点时:c(Na+)>c(A-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】 时,向
时,向 的NaOH溶液中逐滴加入某浓度的
的NaOH溶液中逐滴加入某浓度的 溶液,滴定过程中,溶液的pH与滴入
溶液,滴定过程中,溶液的pH与滴入 溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和,则下列说法中,正确的是
溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和,则下列说法中,正确的是
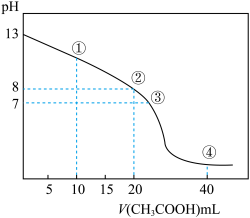
 时,向
时,向 的NaOH溶液中逐滴加入某浓度的
的NaOH溶液中逐滴加入某浓度的 溶液,滴定过程中,溶液的pH与滴入
溶液,滴定过程中,溶液的pH与滴入 溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和,则下列说法中,正确的是
溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和,则下列说法中,正确的是
| A.该滴定过程应该选择甲基橙作为指示剂 |
B.点④所示溶液中存在: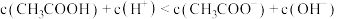 |
| C.图中点①到点③所示溶液中,水的电离程度先减小后增大 |
D.点①所示溶液中存在: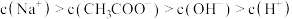 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列溶液中微粒的物质的量浓度关系或说法正确的是
A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O )+c(H2C2O4) )+c(H2C2O4) |
B.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH )大小:①>②>③ )大小:①>②>③ |
| C.0.1mol/L的CH3COOH溶液加水稀释,c(H+)/c(CH3COO-)的比值将增大 |
| D.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是( )
| A.100℃时,KW=10﹣12,此温度下pH=6的溶液一定显酸性 |
| B.25℃时,0.1mol/L的NaHSO3溶液pH=4,说明HSO3﹣在水溶液中只存在电离 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO﹣)+c(CH3COOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】经测定,某溶液中只含有 、Cl-、H+、OH-四种离子,下列说法中错误的是
、Cl-、H+、OH-四种离子,下列说法中错误的是
 、Cl-、H+、OH-四种离子,下列说法中错误的是
、Cl-、H+、OH-四种离子,下列说法中错误的是A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c( )>c(OH-) )>c(OH-) |
B.若溶液中的溶质是NH4Cl 和NH3·H2O,则离子间可能满足:c( )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
C.若溶液中四种离子满足:c(Cl-)>c( )>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl )>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl |
D.若溶液中c(Cl-)=c( ),则该溶液一定呈中性 ),则该溶液一定呈中性 |
您最近一年使用:0次

 时,向
时,向 邻苯二甲酸
邻苯二甲酸 溶液中加入
溶液中加入 固体,混合溶液的pH随
固体,混合溶液的pH随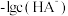 以及
以及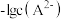 的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发).下列有关叙述错误的是
的关系如图所示(忽略溶液体积变化和邻苯二甲酸的挥发).下列有关叙述错误的是
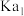 约为
约为
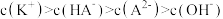
 先增大后减小
先增大后减小 时,
时,