1 . 小宇和同学们在学习化学之后再次走进科技馆,如图所示的连环画记录了他们的参观过程。请据图和叙述回答I-IV题。

I.今天天气晴朗,空气质量优良。
(1)下列属于空气污染物的是_______ (填字母序号).
A. N2B.CO2 C.PM2.5 D.CO
(2)保护人类赖以生存的空气,是每个公民的责任。小宇能做些什么呢?请你给她的出行提出一条建议:_______
II.来到“与门捷列夫对话”展台。看到熟悉的元素周期表,依据图②中显示的信息回答。
(1)氯的相对原子质量为_______
(2)镁元素是核电荷数为_______ 的一类原子的总称。镁原子原子的结构示意图为: ,在化学反应中易
,在化学反应中易___ (填“得”或“失”)电子。
(3)写出图②中一种元素的单质与氧气反应的化学方程式_______ .
Ⅲ.“太空探索”展台周围吸引了很多观众。
航天员出舱所穿的宇航服能为其提供氧气,吸收二氧化碳。用于吸收二氧化碳的物质是氢氧化锂,已知其中锂(Li)的化合价为+1,其化学式为_______
IV.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:

①NH3+O2 →NO+H2O
②NO+O2→NO2
③NO2+H2O→HNO3+NO
(1)上述反应涉及的物质中,属于氧化物的有_______ 种.
(2)反应②的基本反应类型为_______ .
(3)制取硝酸过程中可循环使用的物质是_______

I.今天天气晴朗,空气质量优良。
(1)下列属于空气污染物的是
A. N2B.CO2 C.PM2.5 D.CO
(2)保护人类赖以生存的空气,是每个公民的责任。小宇能做些什么呢?请你给她的出行提出一条建议:
II.来到“与门捷列夫对话”展台。看到熟悉的元素周期表,依据图②中显示的信息回答。
(1)氯的相对原子质量为
(2)镁元素是核电荷数为
 ,在化学反应中易
,在化学反应中易(3)写出图②中一种元素的单质与氧气反应的化学方程式
Ⅲ.“太空探索”展台周围吸引了很多观众。
航天员出舱所穿的宇航服能为其提供氧气,吸收二氧化碳。用于吸收二氧化碳的物质是氢氧化锂,已知其中锂(Li)的化合价为+1,其化学式为
IV.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:

①NH3+O2 →NO+H2O
②NO+O2→NO2
③NO2+H2O→HNO3+NO
(1)上述反应涉及的物质中,属于氧化物的有
(2)反应②的基本反应类型为
(3)制取硝酸过程中可循环使用的物质是
您最近一年使用:0次
解题方法
2 . 铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用。工业经济的飞速发展,对铝合金的需求日益增多,使铝合金的研究也随之深入。已知某合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究。
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应。
猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有___________ (填名称)。
猜想3:该合金粉末中除铝外,还含有铁、铜。
实验探究:下列实验仅供 选择的试剂:10%盐酸、30%NaOH溶液。
探究结论:猜想__________ 成立。
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式________________________________ 。
【拓展与分析】
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱。
方案一:__________________ 。
方案二:_____________ 。
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①_________________ ;②___________________ 。
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应。
猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有
猜想3:该合金粉末中除铝外,还含有铁、铜。
实验探究:下列实验
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的 | 粉末部分溶解,并有气体放出。 | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 | 滤渣部分溶解,并有气体放出,溶液呈浅绿色。 | 合金中一定含有 |
探究结论:猜想
反思:一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式
【拓展与分析】
请设计两个不同的实验方案,验证铝、铜的金属活动性强弱。
方案一:
方案二:
【总结归纳】由上述实验得出比较金属活动性强弱的方法有:
①
您最近一年使用:0次
3 . 物质的性质很大程度上决定了物质的用途.以下是生产、生活中一些物质的用途: ①铜制成导线 ②水通电可以分解 ③氧气可以支持燃烧 ④黄金压成金箔 ⑤石墨可制铅笔芯 ⑥天然气用作燃料
请你从用途中体现出的主要性质角度,将上述用途平均分为两类,其中一类的分类标准是(1)______________________ ,包括事例为(2)________ (填序号).
请你从用途中体现出的主要性质角度,将上述用途平均分为两类,其中一类的分类标准是(1)
您最近一年使用:0次
4 . 下列叙述正确的是
| A.稀释浓硫酸时应将水倒入浓硫酸中,并用玻璃棒不断搅拌 |
| B.将100g溶质质量分数为98%的浓硫酸稀释为49%,需加水50g |
| C.凡电离时能够产生氢氧根离子的一类化合物都称为碱 |
| D.在不同的酸溶液中都含有相同的氢离子,所以,酸有一些相似的性质 |
您最近一年使用:0次
2018-02-05更新
|
255次组卷
|
3卷引用:人教版2018届九年级下册化学同步课时练习:第十单元 课题1 常见的酸和碱2
5 . 分类、类比是初中化学常用的学习方法
(1)我们在学习相对原子质量时引入了碳-12原子,这样的原子可以表示为126C,6表示该种原子的质子数,而12可以理解为该种原子的相对原子质量,请你依据所给原子的这种表示方式,将下列某些原子分成一类,并写出分类依据。
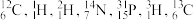
分类标准:____________________________ ,包括的原子有: _______________ .
它们统称为____________________________________ .
(2)在金属活动性顺序中,排在前面的“钾、钙、钠”三种金属活泼性太强,能和水反应, 不能置换活动性弱的金属,例如金属钾与水反应会生成氢氧化钾和氢气。请写出金属钠与氯化镁溶液反应的总的化学方程式__________________________ ,上述反应过程中Na元素的化合价是 __________ 。
(1)我们在学习相对原子质量时引入了碳-12原子,这样的原子可以表示为126C,6表示该种原子的质子数,而12可以理解为该种原子的相对原子质量,请你依据所给原子的这种表示方式,将下列某些原子分成一类,并写出分类依据。
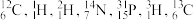
分类标准:
它们统称为
(2)在金属活动性顺序中,排在前面的“钾、钙、钠”三种金属活泼性太强,能和水反应, 不能置换活动性弱的金属,例如金属钾与水反应会生成氢氧化钾和氢气。请写出金属钠与氯化镁溶液反应的总的化学方程式
您最近一年使用:0次
解题方法
6 . 金属是现代生活和工业生产中应用极为普遍的一类材料.
(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示.
①右图中Y所代表的金属是________ (填“Cu”或“Fe”);
②铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是________ ;(用化学方程式回答)
③R为金属,发生如下反应:R+CuSO4=Cu+RSO4.下列说法错误的是________ .
(2)金属的开发和利用是人类文明和社会进步的标志.
钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如图2:
I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:_____________________ .
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入________ 除去.

(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示.
①右图中Y所代表的金属是
②铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
③R为金属,发生如下反应:R+CuSO4=Cu+RSO4.下列说法错误的是
| A.该反应为置换反应 |
| B.R的金属活动性比Cu强 |
| C.该金属可以是Al |
| D.若R为Fe,反应后溶液的质量会减小 |
钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如图2:

I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入

您最近一年使用:0次
真题
7 . 化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质。以金属为例,请你参与其中回答相关问题:
(1)认识金属元素存在:自然界中大多数金属都以化合物的形式存在。
下列矿石的主要成分属于氧化物的是_____ (填字母序号,下同);
A.铝土矿 (主要成分A12O3)
B.钾长石(主要成分KAlSi3O8)
C.赤铁矿 (主要成分Fe2O3)
D.磁铁矿 (主要成分Fe3O4)
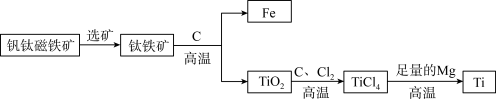
(2)探究金属性质:金属原子容易失去最外层电子,化学性质活泼。图1为探究金属化学 性质的实验,图2是金属化学性质网络图。
①图1甲中反应现象是_______ 丙中反应的化学方程式为____________ ;
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是______________ (填元素符号);
③依据图1完成金属性质网络,图2中的A属于______________________ (填物质类别);
(3)认识金属的制备:工业上常采用还原法、置换法、电解法制备金属。
用一氧化碳还原赤铁矿冶铁反应的化学方程式为___________________________
(4)金属在生产生活中应用广泛。
①下列金属制品的用途,利用其导电性的是________________
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
②合金性能优于单一金属,因而被广泛应用。焊锡(主要含锡、铅)与其组成金属相比
具有____________ 的特性,可用于焊接电子元件;
③ 金属是一种有限资源,需要保护和回收利用。
黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示。
【收集资料】弹壳上的锈主要为Cu2( OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应。
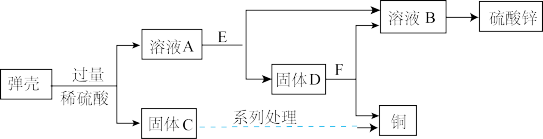
a.写出弹壳上的锈与稀硫酸反应的化学方程式_____________________ 。
b.固体D为________ 。
(1)认识金属元素存在:自然界中大多数金属都以化合物的形式存在。
下列矿石的主要成分属于氧化物的是
A.铝土矿 (主要成分A12O3)
B.钾长石(主要成分KAlSi3O8)
C.赤铁矿 (主要成分Fe2O3)
D.磁铁矿 (主要成分Fe3O4)
(2)探究金属性质:金属原子容易失去最外层电子,化学性质活泼。图1为探究金属化学 性质的实验,图2是金属化学性质网络图。

①图1甲中反应现象是
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是
③依据图1完成金属性质网络,图2中的A属于
(3)认识金属的制备:工业上常采用还原法、置换法、电解法制备金属。
用一氧化碳还原赤铁矿冶铁反应的化学方程式为
(4)金属在生产生活中应用广泛。
①下列金属制品的用途,利用其导电性的是
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
②合金性能优于单一金属,因而被广泛应用。焊锡(主要含锡、铅)与其组成金属相比
具有
③ 金属是一种有限资源,需要保护和回收利用。
黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示。
【收集资料】弹壳上的锈主要为Cu2( OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应。

a.写出弹壳上的锈与稀硫酸反应的化学方程式
b.固体D为
您最近一年使用:0次
2016-11-28更新
|
408次组卷
|
2卷引用:2015年初中毕业升学考试(山东泰安卷)化学
2013·江苏南京·中考模拟
解题方法
8 . 有机高分子材料、金属材料和无机非金属材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)有机高分子材料“玉米塑料”因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少“________ 污染”。我们穿的衣服通常是由纤维织成的,区分棉纤维和羊毛纤维的方法是______________ 。
(2)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于________ 变化(选填“物理”或“化学”)。
(3)无机非金属材料中,用于电子工业的高纯碳酸钙和高纯氧化钙生产流程如下:

①硝酸钙与碳酸铵在溶液中发生反应的化学方程式为:
Ca(NO3)2 + (NH4)2CO3 =CaCO3↓ +___________ 。
②实验室常采用______ 操作进行沉淀分离,该操作需要用到的玻璃仪器是_____________ 。
③生产高纯碳酸钙时,选择“220℃恒温干燥”,而不选择“高温”条件下完成此操作的原因是___________________________________ (用化学方程式说明)。
(1)有机高分子材料“玉米塑料”因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少“
(2)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于
(3)无机非金属材料中,用于电子工业的高纯碳酸钙和高纯氧化钙生产流程如下:

①硝酸钙与碳酸铵在溶液中发生反应的化学方程式为:
Ca(NO3)2 + (NH4)2CO3 =CaCO3↓ +
②实验室常采用
③生产高纯碳酸钙时,选择“220℃恒温干燥”,而不选择“高温”条件下完成此操作的原因是
您最近一年使用:0次
9 . 阅读下面科普短文。
锂电池是指电极材料含金属锂或含锂化合物,使用非水溶液做离子导体的电池。银白色的金属锂是所有金属中最轻的一种,它的化学性质活泼,常温下就能和空气中的氧气化合成氧化锂;锂还能和水剧烈反应变成氢氧化锂(LiOH),同时放出一种可燃性气体。
最早出现的锂电池利用化学反应Li+MnO2 =LiMnO2提供电能。随着科技的发展,锂电池的应用范围逐步扩大,一类新型锂电池——锂离子电池大量应用在手机、笔记本电脑和家用小电器上。锂离子电池由正极、负极、隔膜和电解液构成,正极材料(如石墨)和负极材料(如LiCoO2)均能传导电子,电解液在正、负两极之间起输运离子、传导电流的作用。锂离子电池采用一种类似摇椅式的工作原理,充放电过程中锂离子在正负极间来回穿梭,从一边“摇”到另一边,往复循环,实现电池的充放电过程。
由于锂离子电池中包含的电解液多含有机物,普遍存在易燃问题,在过充、过放、短路及热冲击等滥用的状态下,电池温度迅速升高,常常会导致电池起火,甚至爆炸。因此,目前大多数数码产品都会配备相应的保护元件,当检测到电池到达满电状态,会自动切断充电电路。

依据文章内容,回答下列问题:
(1)金属锂的物质性质有______________ (答一条即可)。
(2)锂离子电池由______________ 构成。
(3)锂离子电池负极材料为LiCoO2,其中Li为+1价,则Co的化合价为____ 。
(4)锂电池使用非水溶液做离子导体的原因是_______ (用化学方程式表示)。
(5)安全使用锂离子电池的措施有__________ 。
锂电池是指电极材料含金属锂或含锂化合物,使用非水溶液做离子导体的电池。银白色的金属锂是所有金属中最轻的一种,它的化学性质活泼,常温下就能和空气中的氧气化合成氧化锂;锂还能和水剧烈反应变成氢氧化锂(LiOH),同时放出一种可燃性气体。
最早出现的锂电池利用化学反应Li+MnO2 =LiMnO2提供电能。随着科技的发展,锂电池的应用范围逐步扩大,一类新型锂电池——锂离子电池大量应用在手机、笔记本电脑和家用小电器上。锂离子电池由正极、负极、隔膜和电解液构成,正极材料(如石墨)和负极材料(如LiCoO2)均能传导电子,电解液在正、负两极之间起输运离子、传导电流的作用。锂离子电池采用一种类似摇椅式的工作原理,充放电过程中锂离子在正负极间来回穿梭,从一边“摇”到另一边,往复循环,实现电池的充放电过程。
由于锂离子电池中包含的电解液多含有机物,普遍存在易燃问题,在过充、过放、短路及热冲击等滥用的状态下,电池温度迅速升高,常常会导致电池起火,甚至爆炸。因此,目前大多数数码产品都会配备相应的保护元件,当检测到电池到达满电状态,会自动切断充电电路。

依据文章内容,回答下列问题:
(1)金属锂的物质性质有
(2)锂离子电池由
(3)锂离子电池负极材料为LiCoO2,其中Li为+1价,则Co的化合价为
(4)锂电池使用非水溶液做离子导体的原因是
(5)安全使用锂离子电池的措施有
您最近一年使用:0次
解题方法
10 . 花儿为什么这样红?主要与植物花瓣中的显色物质——花青素(化学式:C15H11O6)有关。花青素是自然界一类广泛存在于植物中的水溶性天然色素,它的存在使得水果、蔬菜、花卉等呈现出五彩缤纷的颜色。露天烧烤不仅污染环境、导致周边空气中PM2.5指数严重超标,在烧烤的肉类食物中还含有强致癌物质一一苯并 (a) 芘(化学式为C20H12)。试回答下列问题:
(1)在苯并 (a) 芘中,氢元素与碳元素的原子个数之比为_________ (填最筒整数比)。
(2)花青素属于_____________ (填“氧化物”、“无机化合物”、“有机化合物”、
“高分子化合物”中的一项)。
(3)花青素中质量分数最小的元素是___________ 。(写元素符号)
(4)花青素提取物可作为保健品成分,有增强免疫力和抗癌的作用,下列关于保健品的说
法中正确的是____ (填序号)。
(1)在苯并 (a) 芘中,氢元素与碳元素的原子个数之比为
(2)花青素属于
“高分子化合物”中的一项)。
(3)花青素中质量分数最小的元素是
(4)花青素提取物可作为保健品成分,有增强免疫力和抗癌的作用,下列关于保健品的说
法中正确的是
| A.保健品对人体健康有益,人人都应多多服用 |
| B.服用保健品无任何副作用,多吃可治疗百病 |
| C.保健品具有保健功能,可代替药物起治疗作用 |
| D.增进人体健康应以平衡膳食为主,保健品为辅助 |
您最近一年使用:0次



