10-11高二下·北京·阶段练习
解题方法
1 . 体积相同的甲乙两容器中,分别充入1molA和1molB,在相同温度下发生反应:
2A(g)+B(g) ⇌2C(g) 并达到平衡,甲容器保持体积不变,C的体积分数为m%;乙容器保持压强不变,C的体积分数为n%,则m和n的正确关系为
2A(g)+B(g) ⇌2C(g) 并达到平衡,甲容器保持体积不变,C的体积分数为m%;乙容器保持压强不变,C的体积分数为n%,则m和n的正确关系为
| A.m<n | B.m=n | C.m>n | D.无法比较 |
您最近一年使用:0次
10-11高二·江西上饶·阶段练习
2 . 一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g) 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
 H2(g)+
H2(g)+ I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
 H2(g)+
H2(g)+ I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )| A.后一反应的平衡常数为1 |
| B.后一反应的平衡常数为0.5 |
| C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1 |
| D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1 |
您最近一年使用:0次
2016-12-09更新
|
1231次组卷
|
7卷引用:2011-2012学年江西省上饶县中学高二第一次月考化学试卷
(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷2015-2016学年辽宁省沈阳二中高二上10月月考化学试卷2016届辽宁省大连二十四中高三上学期期中测试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学反应的方向和限度吉林省辉煌联盟九校2019-2020学年高三第三次联考化学试题(已下线)专题19 化学平衡常数的计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第七章 化学反应速率与化学平衡 第41练 化学平衡状态 化学平衡常数
11-12高二上·山东日照·期中
名校
解题方法
3 . 2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
您最近一年使用:0次
2016-12-09更新
|
568次组卷
|
7卷引用:2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷
11-12高二上·海南·阶段练习
解题方法
4 . 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。
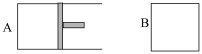
起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
(1)达到平衡所需时间,A容器比B容器_____ ,两容器中SO2的转化率A比B______ 。
(2)达到⑴所述平衡后,若向两容器中分别通入等量Ar气体,A容器的化学平衡_____ 移动,B容器中的化学平衡________ 移动。
(3)达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数_______ ,B容器中SO3的体积分数________ (填变大、变小、不变)。

起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2
 2SO3,并达到平衡。
2SO3,并达到平衡。(1)达到平衡所需时间,A容器比B容器
(2)达到⑴所述平衡后,若向两容器中分别通入等量Ar气体,A容器的化学平衡
(3)达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数
您最近一年使用:0次
11-12高二上·辽宁沈阳·阶段练习
名校
解题方法
5 . 在一定温度下,向一个容积可变的恒压容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是| A.第一次实验平衡时反应放出的热量为98.3kJ |
| B.第一次实验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大 |
| C.第二次实验达平衡时SO3的体积分数大于2/9 |
| D.两次实验平衡时,SO3的浓度相等 |
您最近一年使用:0次
11-12高二上·河南郑州·阶段练习
解题方法
6 . 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是| A.2.5mol C |
| B.2 mol A、1 mol B和10 mol He(不参加反应) |
| C.1.5 mol B和1.5 mol C |
| D.2 mol A、3 mol B和3 mol C |
您最近一年使用:0次
11-12高二上·河北邢台·阶段练习
7 . 在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=_______ mol/(L·min);实验2中采取的措施是_______ ;实验3中n3_______ 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_______ 0(填“>、=、<”),理由是_______
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的_______ 。
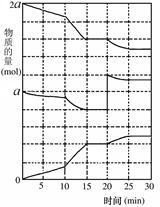
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是_______ ,_______ 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是_______ 。
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
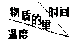 实验序号 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 80℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 80℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 80℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 73℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=
②比较实验4和实验1,可推测该反应中Q
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的

a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
您最近一年使用:0次
8 . 工业合成氨反应:N2+3H2⇌2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为______ 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol, n(H2)=1.2mol, n (NH3)=0.8mol,则反应速率V(N2)=______ mol·L-1·min-1,H2的转化率=______ ,平衡常数=______ 。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡______ (填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为______ mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 =______ mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=______ mol,y=______ mol(用含a的代数式表示)
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol, n(H2)=1.2mol, n (NH3)=0.8mol,则反应速率V(N2)=
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为
您最近一年使用:0次
10-11高三·河北衡水·阶段练习
解题方法
9 . 在恒温恒容的密闭容器中,通入xmol N2和ymol H2发生反应N2+ 3H2 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x=_______ ,y=_______ 。
⑵若起始加入N2、H2和NH3的物质的量分别为amol、bmol、cmol,达平衡时各物质的含量与上述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为________ kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为______________________ 。
 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。⑴通过计算说明起始充入N2和H2的物质的量分别为:x=
⑵若起始加入N2、H2和NH3的物质的量分别为amol、bmol、cmol,达平衡时各物质的含量与上述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为
②若维持反应向正反应方向进行,则起始时c的取值范围为
您最近一年使用:0次
9-10高三·四川成都·阶段练习
10 . 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
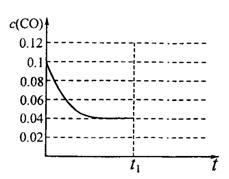
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
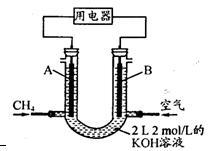
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近一年使用:0次



