9-10高三·四川成都·阶段练习
1 . 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
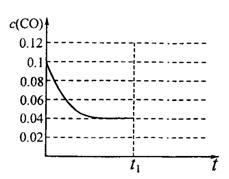
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
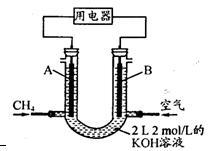
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近一年使用:0次
9-10高三·湖南长沙·阶段练习
名校
解题方法
2 . 在一固定容积的密闭容器中充入3mol A和1mol B,发生反应:3A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
 xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为| A.1 | B.2 | C.3 | D.任意值 |
您最近一年使用:0次
9-10高二下·江苏南京·期末
解题方法
3 . 有两只密闭的容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的两容器中通入体积比为2:l的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
2SO3,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
(1)达到平衡所需的时间:tA___________ tB,S02的转化率:aA___________ aB。
(2)起始时两容器中的反应速率:vA__________ vB,反应过程中的反应速率:vA_____________ vB
(3)达到平衡时,向两容器中分别通入等量的氩气。A容器中的化学平衡向__________ 反应方向移动,B容器中的化学反应速率______________
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中的SO2的百分含量_________ ,B容器中S02的百分含量_________ 。
 2SO3,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
2SO3,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)(1)达到平衡所需的时间:tA
(2)起始时两容器中的反应速率:vA
(3)达到平衡时,向两容器中分别通入等量的氩气。A容器中的化学平衡向
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中的SO2的百分含量
您最近一年使用:0次
2010·黑龙江·模拟预测
解题方法
4 . 在甲、乙两个密闭容器中发生如下反应:2A(g)⇌B(g) +2C(g) ΔH= m kJ/mol,有下列两种图象。有关叙述正确的是
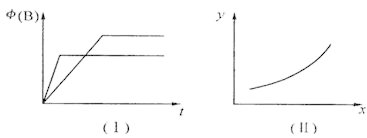

| A.若甲为恒容体系,图象(I)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B.恒温条件下,图象(I)可能代表压强不同时,时间与B的体积分数关系图 |
| C.恒温条件下,若乙容器存在图象(II)关系,则当x代表压强时,y一定代表B的体积分数 |
| D.恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2mol A,乙中充入1mol B、3mol C,则达平衡后两容器中B的体积分数一定相同 |
您最近一年使用:0次
2010·山西太原·高考模拟
名校
解题方法
5 . T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图I所示;若保持其他条件不变,温度分别为Tl和T2时,B的体积百分含量与时间的关系如图Ⅱ所示。则下列结论正确的是
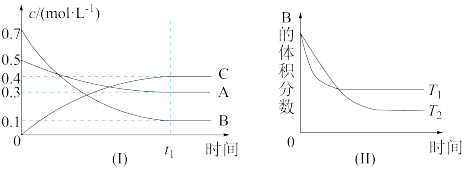

| A.在达平衡后,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.4mol·L-1、0.5 mol·L-1和0.2 mol·L—1,则达到平衡后,C的浓度大于0.4 mol·L-1 |
| D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
您最近一年使用:0次
9-10高二上·吉林·期末
名校
解题方法
6 . 在恒温、恒容的条件下,有反应2A(g)+2B(g)⇌C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径II:C、D的起始浓度分别为2mol·L-1和6mol·L-1;则以下叙述正确的是 ( )
| A.两途径最终到平衡时,体系内混合气的百分组成相同 |
| B.两途径最终达到平衡时,体系内混合气的百分组成不同 |
| C.达平衡时,途径I的反应速率υ(A)等于途径II的反应速率υ(A) |
D.达平衡时,途径I所得混合气的密度为途径II所得混合气密度的 |
您最近一年使用:0次
7 . Ⅰ.制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为____________________ ;
②下列能提高碳的平衡转化率的措施是____________________ 。
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
________________________________________________________________ 。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
________________________________________________________________ 。
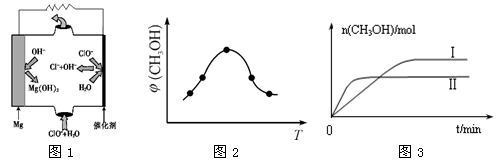
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:_____________________________________________________________ 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH__________ (填“>” “<”或“=”)0。
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ__________________ KⅡ(填“>” “<”或“=”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________________ 。
 CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
②下列能提高碳的平衡转化率的措施是
| A.加入C(s) |
| B.加入H2O(g) |
| C.升高温度 |
| D.增大压强 |
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:

(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H ①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为
您最近一年使用:0次
2016-12-08更新
|
178次组卷
|
2卷引用:2015届陕西省西安市长安一中高三上学期第三次月考化学试卷
8-9高三·浙江·阶段练习
8 . 在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g)⇌2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为_______ 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为_______ ,容器的容积为_______ L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为_______ 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a:b =1:3,则a =_______ 。
(1)达到平衡时,X的转化率约为
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a:b =1:3,则a =
您最近一年使用:0次
10-11高二下·广东广州·期中
解题方法
9 . 已知2X2(g) +Y2(g)⇌2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。
(1)此反应平衡常数表达式为______ ;若将温度降低到300℃,则反应平衡常数将______ (填增大、减少或不变)
(2)若原来容器中只加入2 mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度______ W mol·L–1(填“>”、“<”或“=”),a、b、c之间满足关系______ (用代数式表示)
(3)能说明反应已达平衡状态的是______
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2 mol X2和1mol Y2达到平衡后,Y2的转化率将______ (填变大、变小或不变)
(1)此反应平衡常数表达式为
(2)若原来容器中只加入2 mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度
(3)能说明反应已达平衡状态的是
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2 mol X2和1mol Y2达到平衡后,Y2的转化率将
您最近一年使用:0次
10-11高二·江西上饶·阶段练习
解题方法
10 . 在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g) 2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。
2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________ (填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度为1.2 mol/L的是_____ (用序号填空)。
⑶某温度下,向容器中加入3mol C和0.8mol D,反应达到平衡时C的浓度仍为1.2mol/L,则容器的容积V应大于________ L,小于________ L。
 2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。
2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度为1.2 mol/L的是
| A.4 mol A+2 mol B | B.2 mol C+ 1mol D |
| C.3mol C+1 mol D+1 mol B | D.1.6mol A+0.8 mol B+0.6 mol C |
⑶某温度下,向容器中加入3mol C和0.8mol D,反应达到平衡时C的浓度仍为1.2mol/L,则容器的容积V应大于
您最近一年使用:0次



