1 . “绿水青山就是金山银山。”研究如何将NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1) 可在一定条件下转化为
可在一定条件下转化为 。已知:
。已知:

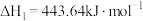

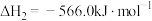
甲醇 是一种重要的化工原料,也可以直接用作燃料。试写出
是一种重要的化工原料,也可以直接用作燃料。试写出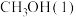 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在___________ (填“正”或“负”)极发生反应,其电极反应式为___________ 。
(3) 可在一定条件下转化为
可在一定条件下转化为 。向
。向 密闭容器中通入
密闭容器中通入 和
和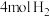 ,在适合的催化剂和
,在适合的催化剂和 温度下,发生反应
温度下,发生反应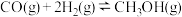
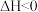 ,保持容器容积一直不变,
,保持容器容积一直不变, 时,反应达到平衡状态,
时,反应达到平衡状态, 时改变温度为
时改变温度为 ,
, 时反应再次达到平衡状态,部分数据如下表:
时反应再次达到平衡状态,部分数据如下表:
① 时反应达到平衡,此时
时反应达到平衡,此时 的转化率为
的转化率为___________ ;化学平衡常数
___________
②
___________ (填“>”“<”或“=”) ;理由
;理由___________
③ 温度下,既能增大反应速率又能提高
温度下,既能增大反应速率又能提高 平䘖转化率的措施有
平䘖转化率的措施有___________ (填一种)。
④恒温恒容时,可以判断反应 达到平衡状态的有
达到平衡状态的有___________ (填标号)。
A.
B.容器内混合气体的压强不再改变
C. 和
和 的转化率的比值保持不变
的转化率的比值保持不变
D.容器内混合气体的平均相对分子质量不变
(1)
 可在一定条件下转化为
可在一定条件下转化为 。已知:
。已知:
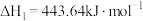

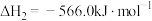
甲醇
 是一种重要的化工原料,也可以直接用作燃料。试写出
是一种重要的化工原料,也可以直接用作燃料。试写出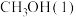 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在
(3)
 可在一定条件下转化为
可在一定条件下转化为 。向
。向 密闭容器中通入
密闭容器中通入 和
和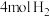 ,在适合的催化剂和
,在适合的催化剂和 温度下,发生反应
温度下,发生反应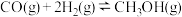
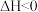 ,保持容器容积一直不变,
,保持容器容积一直不变, 时,反应达到平衡状态,
时,反应达到平衡状态, 时改变温度为
时改变温度为 ,
, 时反应再次达到平衡状态,部分数据如下表:
时反应再次达到平衡状态,部分数据如下表:| 反应时间 |  | 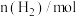 | 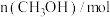 |
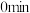 | 2 | 4 | 0 |
 | 1 | ||
 | 0.2 |
 时反应达到平衡,此时
时反应达到平衡,此时 的转化率为
的转化率为
②

 ;理由
;理由③
 温度下,既能增大反应速率又能提高
温度下,既能增大反应速率又能提高 平䘖转化率的措施有
平䘖转化率的措施有④恒温恒容时,可以判断反应
 达到平衡状态的有
达到平衡状态的有A.

B.容器内混合气体的压强不再改变
C.
 和
和 的转化率的比值保持不变
的转化率的比值保持不变 D.容器内混合气体的平均相对分子质量不变
您最近半年使用:0次
解题方法
2 . 推动煤炭清洁高效利用是未来煤炭利用的发展方向,其中煤制天然气(主要成分甲烷)能对燃气资源有重要补充作用。请回答:
(1)生物电化学系统还原CO2是另一种产生甲烷的方法,装置如图所示,写出电解时阴极的电极反应式___________ 。
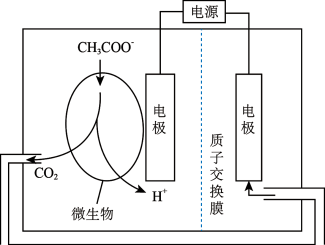
(2)在催化剂作用下,其涉及的主要反应如下:
CO(g) +3H2(g)⇌CH4(g)+H2O(g)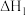 =-206.2 kJ·mol−1 I
=-206.2 kJ·mol−1 I
CO(g)+H2O(g)⇌CO2(g)+H2(g) =-41.2 kJ∙mol−1 II
=-41.2 kJ∙mol−1 II
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) =
=___________ III
其副反应(积碳反应)如下:
2CO(g)⇌CO2(g)+C(s) =-172.0 kJ•mol﹣1 IV
=-172.0 kJ•mol﹣1 IV
CO2(g)+2H2(g)⇌2H2O(g)+C(s)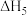 =-90.0 kJ•mol﹣1 V
=-90.0 kJ•mol﹣1 V
CO(g)+H2(g)⇌H2O(g)+C(s)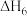 =-131.0 kJ•mol﹣1 VI
=-131.0 kJ•mol﹣1 VI
(3)若原料气n(H2):n(CO)=3:1,且反应容器中只考虑主要反应。
①在催化剂作用下合成天然气,平衡时各组分的体积分数随温度、压强变化如图2、图3所示。根据图象分析,反应I在___________ 条件下有利于反应进行。
A.低温低压 B.低温高压 C.高温低压 D.高温高压

②T2℃,0.1MPa恒压条件条件下,平衡时反应体系平衡组成如表所示。
该条件下CO的总转化率表达式α=___________ 。Kp、Kx分别是以分压、物质的量分数表示的平衡常数,反应I的Kx=___________ 。(以Kp和p总表示)
(4)若反应容器中考虑主、副反应。维持p总=0.1MPa恒定,平衡时CO转化率和积碳的选择性(积碳的选择性=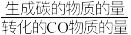 ×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是___________。
×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是___________。
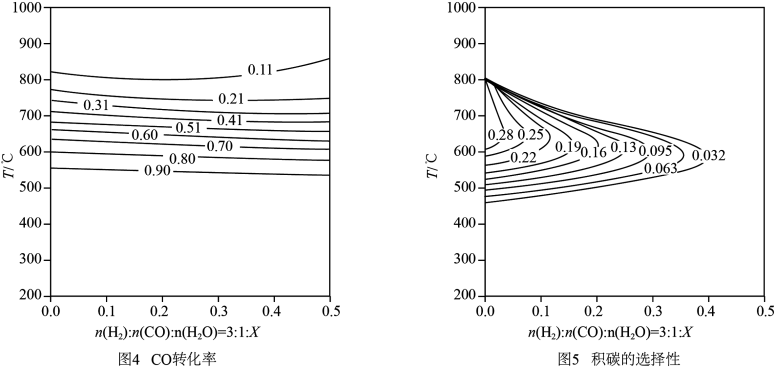
(1)生物电化学系统还原CO2是另一种产生甲烷的方法,装置如图所示,写出电解时阴极的电极反应式

(2)在催化剂作用下,其涉及的主要反应如下:
CO(g) +3H2(g)⇌CH4(g)+H2O(g)
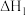 =-206.2 kJ·mol−1 I
=-206.2 kJ·mol−1 ICO(g)+H2O(g)⇌CO2(g)+H2(g)
 =-41.2 kJ∙mol−1 II
=-41.2 kJ∙mol−1 IICO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
 =
=其副反应(积碳反应)如下:
2CO(g)⇌CO2(g)+C(s)
 =-172.0 kJ•mol﹣1 IV
=-172.0 kJ•mol﹣1 IVCO2(g)+2H2(g)⇌2H2O(g)+C(s)
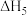 =-90.0 kJ•mol﹣1 V
=-90.0 kJ•mol﹣1 VCO(g)+H2(g)⇌H2O(g)+C(s)
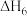 =-131.0 kJ•mol﹣1 VI
=-131.0 kJ•mol﹣1 VI(3)若原料气n(H2):n(CO)=3:1,且反应容器中只考虑主要反应。
①在催化剂作用下合成天然气,平衡时各组分的体积分数随温度、压强变化如图2、图3所示。根据图象分析,反应I在
A.低温低压 B.低温高压 C.高温低压 D.高温高压

②T2℃,0.1MPa恒压条件条件下,平衡时反应体系平衡组成如表所示。
| 组分 | CH4 | H2O | H2 | CO2 | CO |
| 体积分数x | a | b | c | d | e |
(4)若反应容器中考虑主、副反应。维持p总=0.1MPa恒定,平衡时CO转化率和积碳的选择性(积碳的选择性=
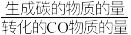 ×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是___________。
×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是___________。
| A.图4中,随着X的增大,CO转化率略有降低,可能原因是反应式Ⅰ中H2O为生成物,增加水蒸气的量会促使平衡向逆反应方向移动 |
| B.图5中,X较低时,在800~850℃积碳选择性减小的原因可能是副反应为放热反应,温度较高,积碳反应平衡逆向移动 |
| C.图5中,X较高时,在550~800℃积碳选择性较低的主要原因是水蒸气的稀释作用使积碳反应速率减小 |
| D.总体上说,X较高,温度低于450℃利于降低积碳,减少积碳对催化剂的影响 |
您最近半年使用:0次
解题方法
3 . 一种将废水中 转化为高附加值
转化为高附加值 的电化学装置如图.
的电化学装置如图.
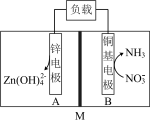
(1)A极为__________ 极(填“正”或“负”).
(2)B极的电极反应为__________ .
(3)M为__________ 离子交换膜(填“阳”或“氢氧根”).
(4)该转化总反应的离子方程式为__________ .
(5)在铜基电极表面上 转化为
转化为 的反应历程如图,吸附在铜基电极表面上的物种用*标注,
的反应历程如图,吸附在铜基电极表面上的物种用*标注,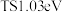 表示能垒(活化能)为1.03eV.
表示能垒(活化能)为1.03eV.

① 转化为
转化为 的
的
___________ 0(填“>”“=”或“<”).
②“ ”中最大能垒(活化能)
”中最大能垒(活化能)
__________ eV,其化学方程式为____________ .
③该电极提高 选择性的原因为
选择性的原因为_______________ .
 转化为高附加值
转化为高附加值 的电化学装置如图.
的电化学装置如图.
(1)A极为
(2)B极的电极反应为
(3)M为
(4)该转化总反应的离子方程式为
(5)在铜基电极表面上
 转化为
转化为 的反应历程如图,吸附在铜基电极表面上的物种用*标注,
的反应历程如图,吸附在铜基电极表面上的物种用*标注,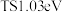 表示能垒(活化能)为1.03eV.
表示能垒(活化能)为1.03eV.
①
 转化为
转化为 的
的
②“
 ”中最大能垒(活化能)
”中最大能垒(活化能)
③该电极提高
 选择性的原因为
选择性的原因为
您最近半年使用:0次
解题方法
4 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。
(1) 加氢制甲烷过程中的主要反应为
加氢制甲烷过程中的主要反应为
主反应: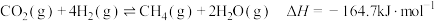
副反应:
则反应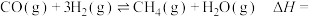
___________  。
。
(2)恒容密闭容器中充入一定量 和
和 ,下列说明主反应和副反应均达到平衡状态的有___________(填标号)。
,下列说明主反应和副反应均达到平衡状态的有___________(填标号)。
(3)500℃时,向1L恒容密闭容器中充入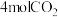 和
和 及催化剂,经10min反应达到平衡后。①测得转化率
及催化剂,经10min反应达到平衡后。①测得转化率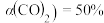 ,生成CO的物质的量为1mol,0~10 min用
,生成CO的物质的量为1mol,0~10 min用 表示的平均反应速率=
表示的平均反应速率=___________ 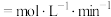 ,主反应的平衡常数
,主反应的平衡常数
___________ 。
② 的平衡转化率与催化剂的催化效率随温度变化结果如图。
的平衡转化率与催化剂的催化效率随温度变化结果如图。

若无催化剂,N点平衡转化率能否降至R点并说明理由___________ 。
(4)往恒容密闭容器中通入 与
与 ,在一定条件下发生反应
,在一定条件下发生反应 ,测得
,测得 的平衡转化率与温度及压强的关系如图所示:
的平衡转化率与温度及压强的关系如图所示:
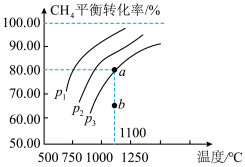
压强 、
、 、
、 中最小的是
中最小的是___________ 。压强为 时,b点:v(正)
时,b点:v(正)___________ (填“<”“=”或“>”)v(逆)。
(5)在稀硫酸中分别以Pt、Cu为电极,利用电催化可将 同时转化为多种燃料,其原理如图所示。
同时转化为多种燃料,其原理如图所示。

 在铜电极被还原为多种燃料,则与Pt电极相连的是电源的
在铜电极被还原为多种燃料,则与Pt电极相连的是电源的___________ 极,写出 催化还原成
催化还原成 的电极反应式
的电极反应式___________ 。
 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。(1)
 加氢制甲烷过程中的主要反应为
加氢制甲烷过程中的主要反应为主反应:
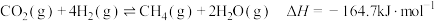
副反应:

则反应
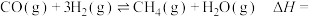
 。
。(2)恒容密闭容器中充入一定量
 和
和 ,下列说明主反应和副反应均达到平衡状态的有___________(填标号)。
,下列说明主反应和副反应均达到平衡状态的有___________(填标号)。| A.混合气体密度不随时间变化 | B.气体总压强不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D. 的消耗速率等于水蒸气生成速率 的消耗速率等于水蒸气生成速率 |
(3)500℃时,向1L恒容密闭容器中充入
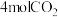 和
和 及催化剂,经10min反应达到平衡后。①测得转化率
及催化剂,经10min反应达到平衡后。①测得转化率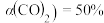 ,生成CO的物质的量为1mol,0~10 min用
,生成CO的物质的量为1mol,0~10 min用 表示的平均反应速率=
表示的平均反应速率=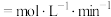 ,主反应的平衡常数
,主反应的平衡常数
②
 的平衡转化率与催化剂的催化效率随温度变化结果如图。
的平衡转化率与催化剂的催化效率随温度变化结果如图。
若无催化剂,N点平衡转化率能否降至R点并说明理由
(4)往恒容密闭容器中通入
 与
与 ,在一定条件下发生反应
,在一定条件下发生反应 ,测得
,测得 的平衡转化率与温度及压强的关系如图所示:
的平衡转化率与温度及压强的关系如图所示:
压强
 、
、 、
、 中最小的是
中最小的是 时,b点:v(正)
时,b点:v(正)(5)在稀硫酸中分别以Pt、Cu为电极,利用电催化可将
 同时转化为多种燃料,其原理如图所示。
同时转化为多种燃料,其原理如图所示。
 在铜电极被还原为多种燃料,则与Pt电极相连的是电源的
在铜电极被还原为多种燃料,则与Pt电极相连的是电源的 催化还原成
催化还原成 的电极反应式
的电极反应式
您最近半年使用:0次
名校
解题方法
5 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:
方法一:氨热分解法制氢气。
相关化学键的键能数据
(1)反应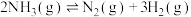

___________  。
。
方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(2)电解过程中 的移动方向为
的移动方向为___________ (填“从左往右”或“从右往左)。
(3)阳极的电极反应式为___________ 。
II. 可用于高效制取氢气,发生的反应
可用于高效制取氢气,发生的反应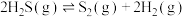 。若起始时容器中只有
。若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
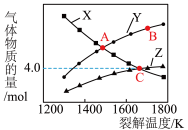
(4)图中曲线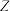 表示的物质是
表示的物质是___________ (填化学式)。
(5) 点时
点时 的转化率为
的转化率为___________  (保留一位小数)。
(保留一位小数)。
(6) 点时,设容器内的总压为
点时,设容器内的总压为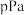 ,则平衡常数
,则平衡常数
___________  (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:
方法一:氨热分解法制氢气。
相关化学键的键能数据
| 化学键 |  |  |  |
键能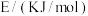 | 946 | 436 | 391 |
(1)反应
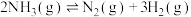

 。
。方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(2)电解过程中
 的移动方向为
的移动方向为(3)阳极的电极反应式为
II.
 可用于高效制取氢气,发生的反应
可用于高效制取氢气,发生的反应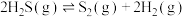 。若起始时容器中只有
。若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
(4)图中曲线
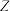 表示的物质是
表示的物质是(5)
 点时
点时 的转化率为
的转化率为 (保留一位小数)。
(保留一位小数)。(6)
 点时,设容器内的总压为
点时,设容器内的总压为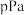 ,则平衡常数
,则平衡常数
 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近半年使用:0次
名校
解题方法
6 . 关于氢能源制取和CO2减排和成为研究热点。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s) 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是___________ 。
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是___________ (填“先升高后降低”或“先降低后升高”),分析原因:___________ 。
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)写出步骤Ⅲ的离子方程式________ 。
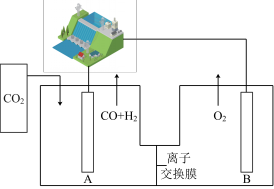
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。
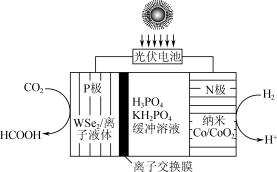
(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为___________ 。
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收___________ mol光子。
(四)已知反应CO2(g)+H2(g) HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。
(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:___________ 。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s)
 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)写出步骤Ⅲ的离子方程式
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。

(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
(四)已知反应CO2(g)+H2(g)
 HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:
您最近半年使用:0次
解题方法
7 . 甲醛(HCHO)在石油化工、医药及能源等行业均有广泛用途,工业上可通过甲醇脱氢的方法合成甲醛,反应原理为: ,回答下列问题:
,回答下列问题:
(1)已知:①
②
反应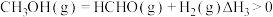 ,则
,则
___________  ,该反应涉及的
,该反应涉及的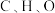 元素的电负性由大到小的顺序是
元素的电负性由大到小的顺序是___________ 。
(2)在密闭容器中入 和适量催化剂
和适量催化剂 ,发生反应
,发生反应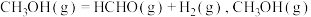 的平衡体积分数随压强变化的曲线如图所示。
的平衡体积分数随压强变化的曲线如图所示。

①图中温度
___________  (填“
(填“ ”、“
”、“ ”或“=”),判断的依据是
”或“=”),判断的依据是___________ 。
② 温度下,根据图中点
温度下,根据图中点 ,计算该处
,计算该处 的平衡转化率为
的平衡转化率为___________ (保留2位小数)。
(3)借助电解技术,可由甲醛为原料制得乙二醇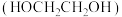 ,装置如图所示。
,装置如图所示。

①阴极上的反应式为___________ 。
②产生标准状况下 ,理论上可制得乙二醇
,理论上可制得乙二醇___________ 
 ,回答下列问题:
,回答下列问题:(1)已知:①

②

反应
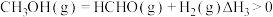 ,则
,则
 ,该反应涉及的
,该反应涉及的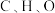 元素的电负性由大到小的顺序是
元素的电负性由大到小的顺序是(2)在密闭容器中入
 和适量催化剂
和适量催化剂 ,发生反应
,发生反应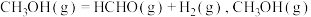 的平衡体积分数随压强变化的曲线如图所示。
的平衡体积分数随压强变化的曲线如图所示。
①图中温度

 (填“
(填“ ”、“
”、“ ”或“=”),判断的依据是
”或“=”),判断的依据是②
 温度下,根据图中点
温度下,根据图中点 ,计算该处
,计算该处 的平衡转化率为
的平衡转化率为(3)借助电解技术,可由甲醛为原料制得乙二醇
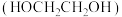 ,装置如图所示。
,装置如图所示。
①阴极上的反应式为
②产生标准状况下
 ,理论上可制得乙二醇
,理论上可制得乙二醇
您最近半年使用:0次
8 . 化学与生产、生活密切相关,下列说法正确的是
A.直接加入稀盐酸即可除去水垢中的 |
| B.要实现铁上镀镍,应将镍电极与电源的正极相连 |
C.明矾可用作净水剂是由于 水解后显酸性 水解后显酸性 |
| D.高温下合成氨是为了提高反应物的平衡转化率 |
您最近半年使用:0次
名校
解题方法
9 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。 是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将
是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将 回收利用,科学家研究利用回收的
回收利用,科学家研究利用回收的 制取甲醛
制取甲醛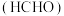 。请回答下列问题:
。请回答下列问题:
(1)已知:①

②
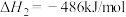
写出 和
和 合成甲醛和水蒸气的热化学方程式
合成甲醛和水蒸气的热化学方程式_____ 。
(2)一定条件下,将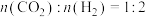 的混合气体充入恒温恒容的密闭容器中,发生反应
的混合气体充入恒温恒容的密闭容器中,发生反应 。
。
下列说明反应已经达到平衡状态的是_____ (填字母)。
a.混合气体的平均相对分子质量不变 b.该反应的平衡常数保持不变
c. 的体积分数保持不变 d.容器内气体密度保持不变
的体积分数保持不变 d.容器内气体密度保持不变
(3)在一定条件下,在容积恒定为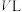 的密闭容器中充入
的密闭容器中充入 与
与 在催化剂作用下合成甲醇:
在催化剂作用下合成甲醇: 。
。 转化率与温度、压强的关系如图所示:
转化率与温度、压强的关系如图所示:
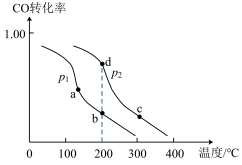
①
_____ (填“ ”“
”“ ”或“
”或“ ”)
”) 。该反应是
。该反应是_____ (填“吸”或“放”)热反应。
②图中b、c、d三点的化学平衡常数为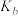 、
、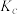 、
、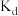 ,从大到小的顺序为
,从大到小的顺序为_____ 。
③比较体系中气体平均摩尔质量: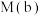
_____ (填“ ”“
”“ ”或“
”或“ ”)
”)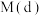 。
。
④电解法制氢气。科研小组设计如图所示电解池,利用 和
和 在碱性电解液中制备水煤气(
在碱性电解液中制备水煤气( 、
、 ),产物中
),产物中 和
和 物质的量之比为
物质的量之比为 。电极B是
。电极B是_____ 极,生成水煤气的电极反应式为_____ 。
 是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将
是目前大气中含量最高的一种温室气体。减弱温室效应的方法之一是将 回收利用,科学家研究利用回收的
回收利用,科学家研究利用回收的 制取甲醛
制取甲醛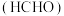 。请回答下列问题:
。请回答下列问题:(1)已知:①


②

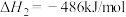
写出
 和
和 合成甲醛和水蒸气的热化学方程式
合成甲醛和水蒸气的热化学方程式(2)一定条件下,将
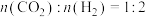 的混合气体充入恒温恒容的密闭容器中,发生反应
的混合气体充入恒温恒容的密闭容器中,发生反应 。
。下列说明反应已经达到平衡状态的是
a.混合气体的平均相对分子质量不变 b.该反应的平衡常数保持不变
c.
 的体积分数保持不变 d.容器内气体密度保持不变
的体积分数保持不变 d.容器内气体密度保持不变(3)在一定条件下,在容积恒定为
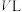 的密闭容器中充入
的密闭容器中充入 与
与 在催化剂作用下合成甲醇:
在催化剂作用下合成甲醇: 。
。 转化率与温度、压强的关系如图所示:
转化率与温度、压强的关系如图所示:
①

 ”“
”“ ”或“
”或“ ”)
”) 。该反应是
。该反应是②图中b、c、d三点的化学平衡常数为
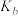 、
、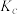 、
、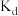 ,从大到小的顺序为
,从大到小的顺序为③比较体系中气体平均摩尔质量:
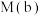
 ”“
”“ ”或“
”或“ ”)
”)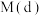 。
。④电解法制氢气。科研小组设计如图所示电解池,利用
 和
和 在碱性电解液中制备水煤气(
在碱性电解液中制备水煤气( 、
、 ),产物中
),产物中 和
和 物质的量之比为
物质的量之比为 。电极B是
。电极B是
您最近半年使用:0次
10 . 实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。
(1)一定条件下,可用二氧化碳加氢合成甲醇。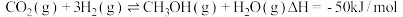 ,该反应经过以下步骤实现:
,该反应经过以下步骤实现:
Ⅰ.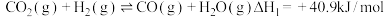
Ⅱ.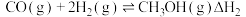
①求
②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
A.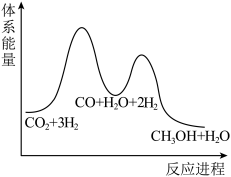
B.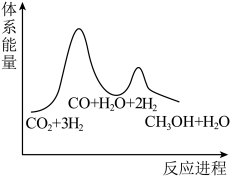
C.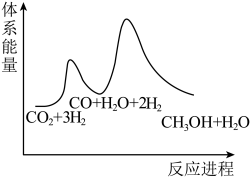
D.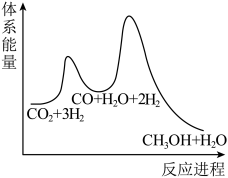
(2)一定条件下也可用二氧化碳加氢合成甲烷: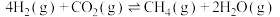 。
。
①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是___________ (填字母)。
A.
B.相同时间内断裂 的数目与断裂
的数目与断裂 数目相等
数目相等
C.容器温度保持不变
D.当 与
与 物质的量之比保持
物质的量之比保持 不变
不变
一定温度下在 恒温恒容密闭容器中初始加入
恒温恒容密闭容器中初始加入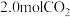 和一定量
和一定量 ,发生上述反应数据如下:
,发生上述反应数据如下:
②该温度下反应的化学平衡常数 为
为___________ 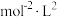
(3)一定条件下也可用二氧化碳加氢合成甲酸
①温度为 时,等物质的量的
时,等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: 。实验测得:
。实验测得: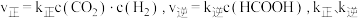 为速率常数。
为速率常数。 时,
时, 。
。
②温度从 到
到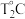 时,
时, ,则
,则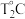 时平衡压强
时平衡压强___________ (填“ "“
"“ ”或“
”或“ ")
") 时平衡压强,理由是
时平衡压强,理由是___________ 。
(4)一定条件下可用二氧化碳提供电能,“溶解”水中的二氧化碳发生电化学反应,产生电能和氢气,其工作原理如图所示。
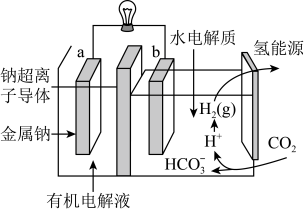
①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液___________ (填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:___________ 。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
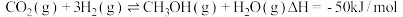 ,该反应经过以下步骤实现:
,该反应经过以下步骤实现:Ⅰ.
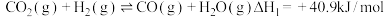
Ⅱ.
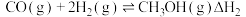
①求

②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是
A.

B.

C.

D.

(2)一定条件下也可用二氧化碳加氢合成甲烷:
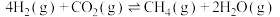 。
。①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是
A.

B.相同时间内断裂
 的数目与断裂
的数目与断裂 数目相等
数目相等C.容器温度保持不变
D.当
 与
与 物质的量之比保持
物质的量之比保持 不变
不变一定温度下在
 恒温恒容密闭容器中初始加入
恒温恒容密闭容器中初始加入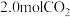 和一定量
和一定量 ,发生上述反应数据如下:
,发生上述反应数据如下: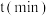 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
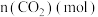 | 2.0 | 1.5 | 1.1 | 0.8 | 0.6 | 0.5 | 0.5 |
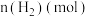 | 3.2 |
 为
为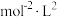
(3)一定条件下也可用二氧化碳加氢合成甲酸
①温度为
 时,等物质的量的
时,等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: 。实验测得:
。实验测得: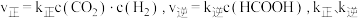 为速率常数。
为速率常数。 时,
时, 。
。②温度从
 到
到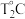 时,
时, ,则
,则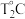 时平衡压强
时平衡压强 "“
"“ ”或“
”或“ ")
") 时平衡压强,理由是
时平衡压强,理由是(4)一定条件下可用二氧化碳提供电能,“溶解”水中的二氧化碳发生电化学反应,产生电能和氢气,其工作原理如图所示。

①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液
②写出二氧化碳生成氢气的电极反应式:
您最近半年使用:0次



