1 .  、
、 既是燃料又是化工原料。工业上,可用煤炭在高温下与水蒸气反应制备水煤气(主要成分为
既是燃料又是化工原料。工业上,可用煤炭在高温下与水蒸气反应制备水煤气(主要成分为 和
和 ),发生的反应为
),发生的反应为 。
。
(1)碳位于周期表中第__________ 周期第__________ 族。
(2)在体积可变的密闭容器中发生上述反应,改变下列条件,不会改变反应速率的是________ (填字母)。
a.增大压强 b.增大炭的质量 c.增大水蒸气浓度 d.升高温度
(3) 和
和 在一定条件下可以合成下列有机物,其中原子利用率小于100%的是
在一定条件下可以合成下列有机物,其中原子利用率小于100%的是_______ (填字母)。
a. b.
b. c.
c. d.
d.
(4) 和
和 在
在 溶液中可以组成燃料电池,装置如图所示。在石墨1极上发生的电极反应为
溶液中可以组成燃料电池,装置如图所示。在石墨1极上发生的电极反应为 ;在石墨2极上发生的电极反应为
;在石墨2极上发生的电极反应为 。
。
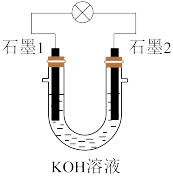
①石墨1极为____________ (填“负”或“正”)极。在石墨2极上发生________ 反应(填“氧化”或“还原”)。
②放电时,电子流向是_________ (填字母)。
a.由石墨1极流出,经外电路流向石墨2极 b.由石墨2极流出,经外电路流向石墨1极
c.由石墨1极流出,经电解质溶液流向石墨2极 d.由石墨1极流出,经电解质溶液流向石墨2极
 、
、 既是燃料又是化工原料。工业上,可用煤炭在高温下与水蒸气反应制备水煤气(主要成分为
既是燃料又是化工原料。工业上,可用煤炭在高温下与水蒸气反应制备水煤气(主要成分为 和
和 ),发生的反应为
),发生的反应为 。
。(1)碳位于周期表中第
(2)在体积可变的密闭容器中发生上述反应,改变下列条件,不会改变反应速率的是
a.增大压强 b.增大炭的质量 c.增大水蒸气浓度 d.升高温度
(3)
 和
和 在一定条件下可以合成下列有机物,其中原子利用率小于100%的是
在一定条件下可以合成下列有机物,其中原子利用率小于100%的是a.
 b.
b. c.
c. d.
d.
(4)
 和
和 在
在 溶液中可以组成燃料电池,装置如图所示。在石墨1极上发生的电极反应为
溶液中可以组成燃料电池,装置如图所示。在石墨1极上发生的电极反应为 ;在石墨2极上发生的电极反应为
;在石墨2极上发生的电极反应为 。
。
①石墨1极为
②放电时,电子流向是
a.由石墨1极流出,经外电路流向石墨2极 b.由石墨2极流出,经外电路流向石墨1极
c.由石墨1极流出,经电解质溶液流向石墨2极 d.由石墨1极流出,经电解质溶液流向石墨2极
您最近半年使用:0次
名校
解题方法
2 . (1)已知在2 L的密闭容器中进行可逆反应aA(g)+bB(g) 2C(g),各物质的有关数据如下:
2C(g),各物质的有关数据如下:
请回答下列问题。
①该可逆反应的化学方程式可表示为____________ 。
②用物质B来表示0~2s的平均反应速率为__________ 。
③从反应开始到2 s末,A的转化率为___________ 。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是______ (填字母)。
A.vB(消耗)=vc(生成)
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.容器内气体C的物质的量分数保持不变
E. vA: vB:vC=4:3 :2
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是____________ 。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如下,则该燃料电池工作时,负极的电极反应式为__________ ,电池的总反应方程式为____________ 。

 2C(g),各物质的有关数据如下:
2C(g),各物质的有关数据如下:物质 | A | B | C |
| 起始物质的量浓度/mol·L-1 | 1.5 | 1.2 | 0 |
| 2s末物质的量浓度/mol·L-1 | 0.7 | 0.6 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为
②用物质B来表示0~2s的平均反应速率为
③从反应开始到2 s末,A的转化率为
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.vB(消耗)=vc(生成)
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.容器内气体C的物质的量分数保持不变
E. vA: vB:vC=4:3 :2
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如下,则该燃料电池工作时,负极的电极反应式为

您最近半年使用:0次
3 . 采用科学技术减少碳氧化物、氮氧化物等物质的排放,可促进社会主义生态文明建设。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。
①已知:CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1;
在深海中有一种甲烷细菌依靠酶使甲烷与O2作用产生的能量存活。酶使1mol甲烷生成CO2气体与液态水,放出的能量__________ (填“>”“<”或“=”)890.3kJ。
②甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要先通入适量空气使部分甲烷燃烧,其目的是____________ 。
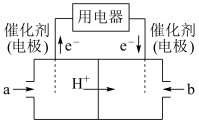
③利用CH4的燃烧可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如下图所示,则通入a气体的电极名称为________ ,通入b气体的电极反应式为_______ (质子交换膜只允许H+通过)
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见下图。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为____________ (填序号)。

(3)以TiO2/Cu2Al2O4为催化剂,也可以将CO2和CH4直接转化成乙酸。
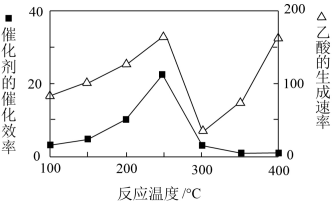
①在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。乙酸的生成速率主要取决于温度影响的范围是_________ ;
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为__________ 。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。
①已知:CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1;
在深海中有一种甲烷细菌依靠酶使甲烷与O2作用产生的能量存活。酶使1mol甲烷生成CO2气体与液态水,放出的能量
②甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要先通入适量空气使部分甲烷燃烧,其目的是
③利用CH4的燃烧可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如下图所示,则通入a气体的电极名称为

(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见下图。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为

(3)以TiO2/Cu2Al2O4为催化剂,也可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。乙酸的生成速率主要取决于温度影响的范围是

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为
您最近半年使用:0次
名校
解题方法
4 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的△H=____ 。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是______ 。

(2)O2辅助的A1-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
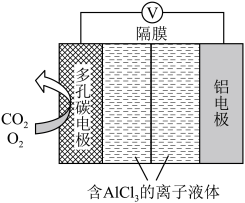
电池的负极反应式:_____ 。
电池的正极反应式:6O2+6e-=6O2- ;6CO2+6O2-=3C2O +6O2
+6O2
反应过程中O2的作用是_____ 。该电池的总反应式:_____ 。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C O(CO) O(CO) |
| 键能/kJ⋅mol-1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900℃的原因是

(2)O2辅助的A1-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

电池的负极反应式:
电池的正极反应式:6O2+6e-=6O2- ;6CO2+6O2-=3C2O
 +6O2
+6O2反应过程中O2的作用是
您最近半年使用:0次
2020-08-28更新
|
43次组卷
|
2卷引用:河北省张家口市第一中学2019-2020学年高二上学期开学考试化学试题(实验班)
5 . 由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:CO燃烧热的ΔH1=-283.0kJ/mol
N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ/mol,则ΔH=_____________ 。
(2)某研究小组对反应NO2+SO2 SO3+NO ΔH <0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)],部分实验结果如图1所示。
SO3+NO ΔH <0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)],部分实验结果如图1所示。

①如果将图中B点的平衡状态改变为C点的平衡状态,应采取的措施是_____ 。
②图中B、D两点对应的实验温度分别为TB和TD,通过计算判断:TB___ TD(填“>”“=”或“<”)。
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法K2S2O8氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
①K2S2O8水解时生成H2O2和KHSO4,写出该反应的化学方程式:_______ 。
②过二硫酸钾可通过电解KHSO4溶液的方法制得。电解液中含硫微粒主要存在形式与pH的关系如图2所示。
已知在阳极放电的离子主要是HSO ,阳极区电解质溶液的pH范围为
,阳极区电解质溶液的pH范围为___ ;阳极的电极反应式为____ 。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH已知:CO燃烧热的ΔH1=-283.0kJ/mol
N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ/mol,则ΔH=
(2)某研究小组对反应NO2+SO2
 SO3+NO ΔH <0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)],部分实验结果如图1所示。
SO3+NO ΔH <0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)],部分实验结果如图1所示。

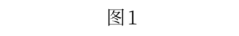
①如果将图中B点的平衡状态改变为C点的平衡状态,应采取的措施是
②图中B、D两点对应的实验温度分别为TB和TD,通过计算判断:TB
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法K2S2O8氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
①K2S2O8水解时生成H2O2和KHSO4,写出该反应的化学方程式:
②过二硫酸钾可通过电解KHSO4溶液的方法制得。电解液中含硫微粒主要存在形式与pH的关系如图2所示。
已知在阳极放电的离子主要是HSO
 ,阳极区电解质溶液的pH范围为
,阳极区电解质溶液的pH范围为
您最近半年使用:0次
2020-08-28更新
|
160次组卷
|
3卷引用:湖南省长沙市第一中学2020届高三第6次月考化学试题
6 . 煤燃烧后的主要产物是CO、CO2。
(1)已知:①C(s)+H2O(g) CO(g)+H2(g) △H1=+131.3kJ/mol
CO(g)+H2(g) △H1=+131.3kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.3kJ/mol
CO(g)+H2O(g) △H2=+41.3kJ/mol
③C(s)+2H2O(g) CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3
△H3=__ kJ/mol,在反应②的体系中加入催化剂,△H2____ (填“增大”“减小”或“不变")。
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol;向1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol;向1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1所示。
①图1中N表示的是__ (填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=__ (保留两位有效数字)mol/(L·min)。

②在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强。X表示的物理量是__ (填“温度"或“压强”),L1__ (填“>”或“<")L2。
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应:2CO2(g) 2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。
2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。
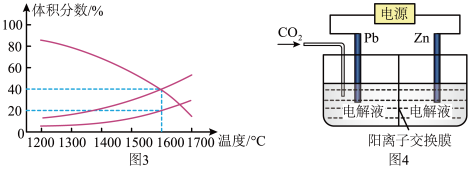
1600℃时反应达到平衡,则此时反应的平衡常数K=__ 。
(4)草酸锌可应用于有机合成、电子工业等。工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Pb电极是__ (填“正”“负”“阴”或“阳”)极。则Zn电极上的电极反应式为__ 。
(1)已知:①C(s)+H2O(g)
 CO(g)+H2(g) △H1=+131.3kJ/mol
CO(g)+H2(g) △H1=+131.3kJ/mol②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.3kJ/mol
CO(g)+H2O(g) △H2=+41.3kJ/mol③C(s)+2H2O(g)
 CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3△H3=
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol;向1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol;向1L的恒容密闭容器中充入1molCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1所示。①图1中N表示的是

②在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强。X表示的物理量是
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应:2CO2(g)
 2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。
2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。
1600℃时反应达到平衡,则此时反应的平衡常数K=
(4)草酸锌可应用于有机合成、电子工业等。工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Pb电极是
您最近半年使用:0次
解题方法
7 . 用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2molCO2和6molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),请回答下列问题:
CH3OH(g)+H2O(g),请回答下列问题:
(1)能判断该反应已达化学平衡状态的标志是___ (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的密度保持不变
D.CO2的生成速率与CH3OH的生成速率相等
(2)现测得CO2和CH3OH(g)的浓度随时间变化如图所示,回答下列问题:
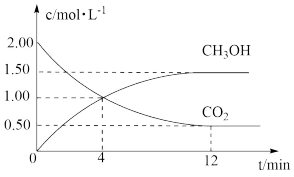
①从反应开始到平衡,氢气的平均反应速率v(H2)=___ 。
②平衡时甲醇的体积分数为___ ;CO2的转化率为___ 。
(3)以KOH为电解质溶液的甲醇燃料电池的总反应为2CH3OH+3O2+4KOH=2KCO3+6H2O。通入氧气的电极为燃料电池的___ (填“正”或“负”)极,负极发生的电极反应式为___ 。
 CH3OH(g)+H2O(g),请回答下列问题:
CH3OH(g)+H2O(g),请回答下列问题:(1)能判断该反应已达化学平衡状态的标志是
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的密度保持不变
D.CO2的生成速率与CH3OH的生成速率相等
(2)现测得CO2和CH3OH(g)的浓度随时间变化如图所示,回答下列问题:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②平衡时甲醇的体积分数为
(3)以KOH为电解质溶液的甲醇燃料电池的总反应为2CH3OH+3O2+4KOH=2KCO3+6H2O。通入氧气的电极为燃料电池的
您最近半年使用:0次
8 . 甲醇是一种重要的化工原料,在生产中有着重要的应用。
(1)已知:①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H=-638.5kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
③H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l)的△H=____ kJ·mol-1。
(2)工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)⇌CH3OH(g) △H1
Ⅱ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H2<0
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3>0
①已知升高温度,反应Ⅰ的平衡常数K减小,则该反应的△H1____ 0(填“>”或“<”)
②对反应Ⅱ而言,下列叙述中,能说明该反应达到平衡状态的是____ 。
a.单位时间内消耗1molCO2的同时生成3molH2
b.反应过程中c(CO2):c(CH3OH)=1:1
c.恒温恒容时,混合气体的密度保持不变
d.绝热恒容时,反应的平衡常数不再变化
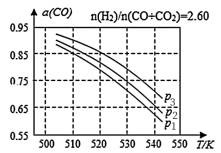
③上述反应体系中,当合成气的组成n(H2)/n(CO+CO2)=2.50时,体系中CO的平衡转化率(α)与温度和压强的关系如图所示。则图中压强由大到小的顺序为____ ,α(CO)值随温度升高而减小的原因是____ 。
(3)用甲醇、二氧化碳可以在一定条件下合成碳酸二甲酯(CH3OCOOCH3,简称DMC),其反应的化学方程式为:2CH3OH(g)+CO2(g)⇌CH3OCOOCH3(g)+H2O(g)。在体积为2L的密闭容器中投入4molCH3OH和2molCO2合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图所示。则:
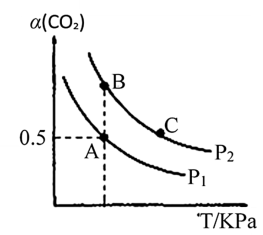
①A点时该反应的平衡常数K=____ (mol·L-1)-1。
②A、B、C三点的速率v(A)、v(B)、v(C)由快到慢的顺序为____ 。
(4)写出以KOH溶液为电解质溶液,甲醇燃料电池的负极反应式:____ 。
(1)已知:①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H=-638.5kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
③H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l)的△H=
(2)工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)⇌CH3OH(g) △H1
Ⅱ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H2<0
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3>0
①已知升高温度,反应Ⅰ的平衡常数K减小,则该反应的△H1
②对反应Ⅱ而言,下列叙述中,能说明该反应达到平衡状态的是
a.单位时间内消耗1molCO2的同时生成3molH2
b.反应过程中c(CO2):c(CH3OH)=1:1
c.恒温恒容时,混合气体的密度保持不变
d.绝热恒容时,反应的平衡常数不再变化
③上述反应体系中,当合成气的组成n(H2)/n(CO+CO2)=2.50时,体系中CO的平衡转化率(α)与温度和压强的关系如图所示。则图中压强由大到小的顺序为

(3)用甲醇、二氧化碳可以在一定条件下合成碳酸二甲酯(CH3OCOOCH3,简称DMC),其反应的化学方程式为:2CH3OH(g)+CO2(g)⇌CH3OCOOCH3(g)+H2O(g)。在体积为2L的密闭容器中投入4molCH3OH和2molCO2合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图所示。则:

①A点时该反应的平衡常数K=
②A、B、C三点的速率v(A)、v(B)、v(C)由快到慢的顺序为
(4)写出以KOH溶液为电解质溶液,甲醇燃料电池的负极反应式:
您最近半年使用:0次
9 . 游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,使活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
I.氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为0.5L的恒容密闭容器中,反应过程中各物质的物质的量变化如图所示:
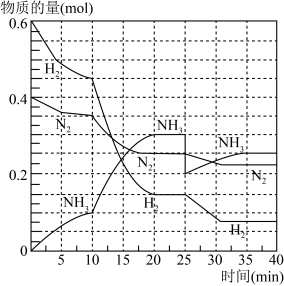
(1)10min内用NH3表示该反应的平均速率,v(NH3)=________________ 。
(2)在第10min和第25min改变的条件可能分别是________________ 、______________ (填字母代号)。
A.加了催化剂
B.降低温度
C.增加NH3的物质的量
D.往容器内充入He
E.分离出氨气
(3)下列能说明该可逆反应达到平衡状态的是__________ (填字母代号)。
A.容器中气体密度不变
B.容器中压强不变
C.3v(H2)正=2v(NH3)逆
D.N2、H2、NH3分子数之比为1:3:2
II.催化转化为惰性氮
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。在25℃、101kPa时:
N2(g)+3H2(g)⇌2NH3(g) ΔH1= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(1) ΔH2= -571.6kJ/mol
N2(g)+O2(g)=2NO(g) ΔH3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式为______________________________ 。
III.按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
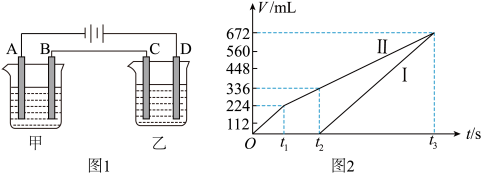
(1)甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
t2时所得溶液的pH=___________ 。
(2)乙槽中盛放足量的硫酸铜溶液,电解后,若使乙槽内的溶液完全复原,可向乙槽中加入______________ (填字母代号)。
A.Cu(OH)2B.CuO
C.CuCO3D.Cu2(OH)2CO3
I.氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为0.5L的恒容密闭容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=
(2)在第10min和第25min改变的条件可能分别是
A.加了催化剂
B.降低温度
C.增加NH3的物质的量
D.往容器内充入He
E.分离出氨气
(3)下列能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变
B.容器中压强不变
C.3v(H2)正=2v(NH3)逆
D.N2、H2、NH3分子数之比为1:3:2
II.催化转化为惰性氮
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。在25℃、101kPa时:
N2(g)+3H2(g)⇌2NH3(g) ΔH1= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(1) ΔH2= -571.6kJ/mol
N2(g)+O2(g)=2NO(g) ΔH3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式为
III.按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

(1)甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
t2时所得溶液的pH=
(2)乙槽中盛放足量的硫酸铜溶液,电解后,若使乙槽内的溶液完全复原,可向乙槽中加入
A.Cu(OH)2B.CuO
C.CuCO3D.Cu2(OH)2CO3
您最近半年使用:0次
名校
解题方法
10 . Ⅰ.燃料电池是一种高效、环境友好的供电装置,下图是甲烷燃料电池原理示意图:
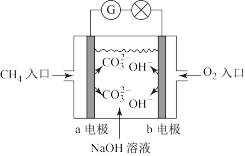
(1)a电极为__________ (填“正极”或“负极”),b电极发生_________ 反应(填“氧化”或“还原”);
(2)外电路中电子从b电极_________ (填“流入”或“流出”),内电路中OH-移向__________ 极(填”a”或”b”);
(3)写出该装置中负极上的电极反应式:________________________ 。
Ⅱ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
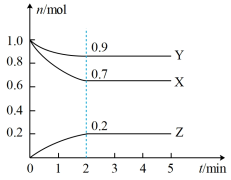
(4)图中对应的化学反应方程式为:________________________
(5)从开始至2min,Z的平均反应速率为____________ ;达到平衡状态时,X的转化率为____________
(6)将amolX与bmolY混合发生上述反应,反应到某时刻,各气体的物质的量恰好满足n(X)=n(Y)=2n(Z),则原混合气体中a:b=____________

(1)a电极为
(2)外电路中电子从b电极
(3)写出该装置中负极上的电极反应式:
Ⅱ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(4)图中对应的化学反应方程式为:
(5)从开始至2min,Z的平均反应速率为
(6)将amolX与bmolY混合发生上述反应,反应到某时刻,各气体的物质的量恰好满足n(X)=n(Y)=2n(Z),则原混合气体中a:b=
您最近半年使用:0次



