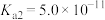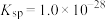名校
解题方法
1 .  常用作媒染剂、脱色剂。某工艺通过如下流程制备氯化亚铜固体(已知
常用作媒染剂、脱色剂。某工艺通过如下流程制备氯化亚铜固体(已知 容易被氧化):
容易被氧化):
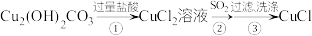
下列说法正确的是
 常用作媒染剂、脱色剂。某工艺通过如下流程制备氯化亚铜固体(已知
常用作媒染剂、脱色剂。某工艺通过如下流程制备氯化亚铜固体(已知 容易被氧化):
容易被氧化):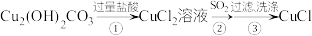
下列说法正确的是
| A.步骤①和②发生的反应均为氧化还原反应 |
B. 所含质子数和电子数相等 所含质子数和电子数相等 |
C. 和 和 均为酸性氧化物 均为酸性氧化物 |
D.铜在潮湿的空气中可生成 |
您最近半年使用:0次
名校
解题方法
2 . 碳酸铈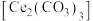 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为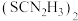 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 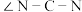 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,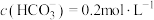 ,此时
,此时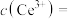
__________ 。已知常温下:
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: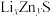 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为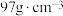 )。
)。
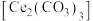 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: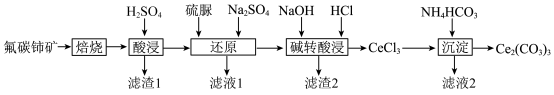
①“酸浸”后铈元素主要以
 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为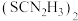 。
。①该反应的离子方程式为
②硫脲属于

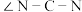 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
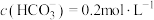 ,此时
,此时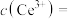
|
| |
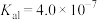 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
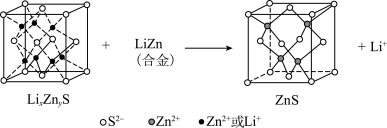
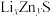 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为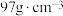 )。
)。
您最近半年使用:0次
昨日更新
|
168次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高三下学期4月月考化学试题
名校
解题方法
3 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为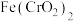 ,还含有
,还含有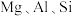 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾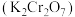 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时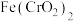 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
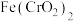 ,还含有
,还含有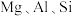 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾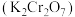 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
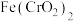 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近半年使用:0次
4 . 铁及其化合物在生产、生活中有着广泛的应用。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为_______ ,为了将反应后溶液中的Cu2+回收利用,并得到含有一种溶质的溶液,进行的具体操作是_______ 。
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是_______ L(标准状况下)。
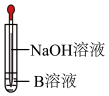
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式_______ 。_______ 。
②酸浸时,Fe3O4与硫酸反应的化学方程式为_______ ;通入O2的目的是_______ 。
③滤渣的成分是_______ (填化学式)。
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量( 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是_______ 。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式
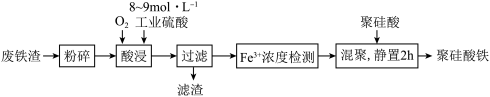
②酸浸时,Fe3O4与硫酸反应的化学方程式为
③滤渣的成分是
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量(
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
您最近半年使用:0次
解题方法
5 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍并制备硫酸镍晶体:
(1)“碱浸”中NaOH的作用有 ___________ 、___________ 。
(2)滤液②中含有的金属离子是 ___________。
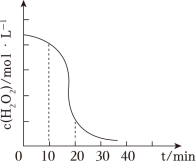
(3)“转化”步骤中H2O2的作用是 ___________ ,c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因可能是 ___________ 。(不考虑温度变化)
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
(5)从滤液③中获得NiSO4•6H2O晶体的操作依次是 ___________ 、___________ 、过滤、洗涤、干燥。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是___________ 。
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?___________ (结果精确至0.1,写出计算过程)
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。___________ 。

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Ni2+ | 7.2 | 8.7 |
| Al3+ | 3.7 | 4.7 |
| Fe3+ | 2.2 | 3.2 |
| Fe2+ | 7.5 | 9.5 |
(2)滤液②中含有的金属离子是 ___________。
| A.Ni2+ | B.Al3+ | C.Fe3+ | D.Fe2+ |
| A.2.2 | B.3.2 | C.3.7 | D.4.7 |
资料显示,硫酸镍结晶水合物的形态与温度有如表的关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其目的是
实验室有一份NiSO4•xH2O样品,为测定其结晶水数目x,将4.188g样品加热至300℃充分反应,最终残留固体质量为2.328g。
(7)该样品中结晶水数目x为多少?
(8)再设计一种实验方案测定样品结晶水数目x(简述实验过程)。
您最近半年使用:0次
名校
解题方法
6 . 联合制碱法的主要过程如图所示(部分物质已略去)。___________ 。
(2)下列说法中合理的是___________。
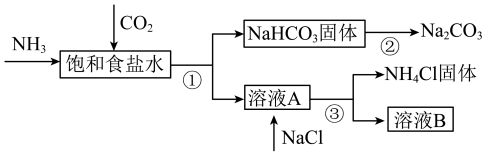
(2)下列说法中合理的是___________。
A.副产物 可用作氮肥 可用作氮肥 |
B.溶液B中的主要离子是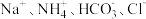 |
C.制碱流程中可回收并循环利用的物质只有 分解产生的 分解产生的 |
D.饱和食盐水中应该先通 至饱和,再通入 至饱和,再通入 至饱和 至饱和 |
您最近半年使用:0次
解题方法
7 . 以红土镍镉矿(NiS、CdO,含 、CuO、PbO、
、CuO、PbO、 等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
(1)“浆化”的目的是_____ 。
(2)滤渣Ⅰ中含有硫单质,写出“酸浸”时NiS反应的离子方程式_____ ;滤渣Ⅰ中还含有_____ 。(填化学式)
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度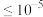 mol/L)的pH如下表,则物质X不可能是
mol/L)的pH如下表,则物质X不可能是_____ ;所调pH范围_____ 。
a. b.CuO c.
b.CuO c.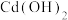 d.NaOH
d.NaOH
(4)电解时阴极的电极反应为_____ 。
(5)整个流程中可以循环使用的物质有______ 。(填化学式)
 、CuO、PbO、
、CuO、PbO、 等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示:
等杂质)为原料回收贵重金属Ni、Cd和Cu,其工艺流程如图所示: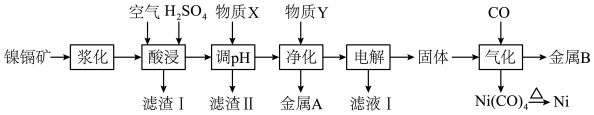
| 物质 | 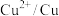 | 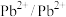 | 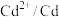 | 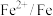 | 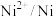 |
| E/V | +0.34 | -0.13 | -0.40 | -0.44 | -0.26 |
(1)“浆化”的目的是
(2)滤渣Ⅰ中含有硫单质,写出“酸浸”时NiS反应的离子方程式
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度
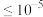 mol/L)的pH如下表,则物质X不可能是
mol/L)的pH如下表,则物质X不可能是| 离子 |  |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 4.7 | 6.8 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 6.7 | 9.2 |
 b.CuO c.
b.CuO c.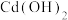 d.NaOH
d.NaOH(4)电解时阴极的电极反应为
(5)整个流程中可以循环使用的物质有
您最近半年使用:0次
名校
解题方法
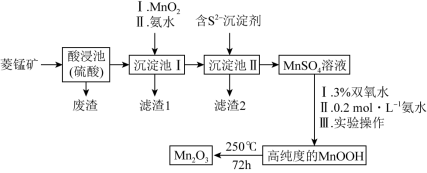
8 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图:
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为_______ 价。
(2)向“沉淀池I”中加入MnO2,MnO2的作用是_______ ,在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(3)MnSO4转化为MnOOH的离子方程式为_______ 。
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为_______ 。
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。_______ 。
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为_______ g•cm-3(列出计算式即可)。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池I”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。
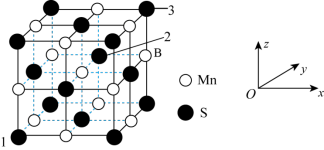
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为
您最近半年使用:0次
名校
解题方法
9 . 采用氧化沉淀法可以利用绿矾制取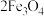 ,其制取流程如图所示:
,其制取流程如图所示:___________ (填写化学式),由溶液 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→___________ →过滤洗涤 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。
(2)某兴趣小组模仿如图流程制取 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取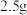 工业绿矾,配制成
工业绿矾,配制成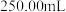 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用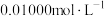 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为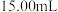 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为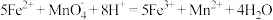 )则绿矾的质量分数为
)则绿矾的质量分数为___________ (计算结果保留三位小数)。
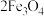 ,其制取流程如图所示:
,其制取流程如图所示:
 获得该副产品的操作是:蒸发浓缩→
获得该副产品的操作是:蒸发浓缩→ 晶体加热至完全失去结晶水。
晶体加热至完全失去结晶水。(2)某兴趣小组模仿如图流程制取
 ,在实验前要测定绿矾的含量:称取
,在实验前要测定绿矾的含量:称取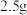 工业绿矾,配制成
工业绿矾,配制成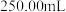 溶液。量取
溶液。量取 溶液于锥形瓶中,用
溶液于锥形瓶中,用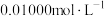 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的平均体积为
溶液的平均体积为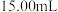 。(滴定时发生反应的离子方程式为
。(滴定时发生反应的离子方程式为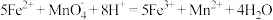 )则绿矾的质量分数为
)则绿矾的质量分数为
您最近半年使用:0次
解题方法
10 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为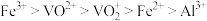 ;
;
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为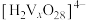 ,其中
,其中
________ 。 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
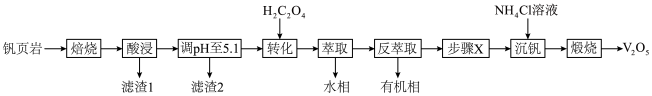
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为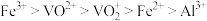 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是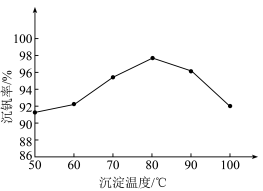
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为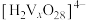 ,其中
,其中
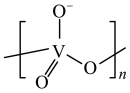
 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是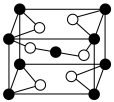
您最近半年使用:0次