名校
解题方法
1 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:___________ ;向混合溶液中通入热空气的反应的离子方程式是___________ ;可循环利用的物质是___________ (填化学式)。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:___________ 。(氨水用“NH3·H2O”表示)
②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是___________ 。
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标
①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程___________ 。
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的___________ (填字母)。
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
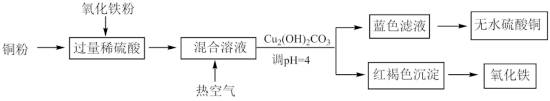
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
您最近一年使用:0次
2024-05-03更新
|
173次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
2 . 13.6gFe和Fe2O3的混合物,加入150mL足量的稀硫酸,在标准状况下收集到1.12LH2,向反应后的溶液中滴入KSCN溶液不变红。为中和过量的H2SO4,并使Fe元素恰好全部转化为Fe(OH)2沉淀,恰好消耗了200mL3mol/L的NaOH溶液(忽略溶液体积变化)。下列说法正确的是
| A.混合物中Fe2O3的物质的量为0.1mol |
| B.混合物中Fe的物质的量为0.5mol |
| C.原硫酸的浓度为2mol/L |
| D.与固体粉末反应的硫酸的物质的量为0.6mol |
您最近一年使用:0次
2023-03-13更新
|
378次组卷
|
3卷引用:吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . 铁是人类较早使用的金属之一,FeSO4和FeCl3是重要的化工原料。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量_______ (填标号,下同);向FeSO4溶液加入_______ 可验证该溶液是否变质。
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是_______ 。(已知:Fe2+遇铁氰化钾溶液产生蓝色沉淀)
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:
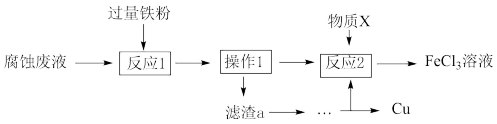
①滤渣a为_______ 。
②物质X为_______ 。
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是_______
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为_______ 。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣a为
②物质X为
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为
您最近一年使用:0次
2023-02-14更新
|
299次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
名校
解题方法
4 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取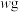 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
519次组卷
|
7卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
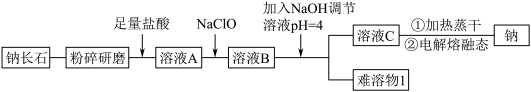
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
524次组卷
|
6卷引用:吉林省松原市2022-2023学年高一上学期期中化学试题
6 . 2021年10月河南省地矿局发现一特大型金矿。下图为纯化黄金(纯度>90%,含铁、铜化合物等杂质)的工艺流程图。下列说法不正确的是


A.往四氯金酸中加入 溶液,当 溶液,当 被氧化时,反应转移1.5mol电子 被氧化时,反应转移1.5mol电子 |
B.王水溶金生成 和NO的化学方程式为 和NO的化学方程式为 |
| C.实验室进行操作A用到的玻璃仪器有漏斗、玻璃棒、烧杯 |
| D.操作A所得金粉会吸附铁的化合物,加盐酸的目的是为了将吸附的杂质溶解除去 |
您最近一年使用:0次
2022-04-11更新
|
629次组卷
|
4卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
解题方法
7 . 三聚氯氰(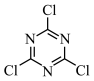 )是许多农药、活性染料和荧光增白剂的重要原料,实验室可用如图所示装置制备(部分装置省略)。
)是许多农药、活性染料和荧光增白剂的重要原料,实验室可用如图所示装置制备(部分装置省略)。

回答下列问题:
(1)仪器a的名称为___________ 。
(2)检查装置B的气密性操作为___________ 。
(3)装置A的作用为___________ 。可选用的试剂为___________ (填标号),发生反应的离子方程式为___________ 。
A.浓盐酸和MnO2 B.盐酸和KMnO4
(4)装置B中盛放的试剂是___________ ,该装置的作用是___________ 。
(5)装置C中是为了获得氯化氰(CNCl)。发生反应的化学方程式为___________ 。
(6)装置E出来的尾气中含有___________ (填化学式),可用___________ (填试剂)除去。
 )是许多农药、活性染料和荧光增白剂的重要原料,实验室可用如图所示装置制备(部分装置省略)。
)是许多农药、活性染料和荧光增白剂的重要原料,实验室可用如图所示装置制备(部分装置省略)。
回答下列问题:
(1)仪器a的名称为
(2)检查装置B的气密性操作为
(3)装置A的作用为
A.浓盐酸和MnO2 B.盐酸和KMnO4
(4)装置B中盛放的试剂是
(5)装置C中是为了获得氯化氰(CNCl)。发生反应的化学方程式为
(6)装置E出来的尾气中含有
您最近一年使用:0次
2022-03-24更新
|
367次组卷
|
3卷引用:吉林省白山市2021-2022学年下学期高三第一次模拟考试理综化学试题
吉林省白山市2021-2022学年下学期高三第一次模拟考试理综化学试题(已下线)三轮冲刺卷03-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)广东省汕头市潮南区陈店实验学校2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
8 . 向Fe2O3和铁粉的混合物中加入适量稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1,那么该反应中Fe2O3、Fe、H2SO4的物质的量之比为
| A.1:1:1 |
| B.1:2:3 |
| C.1:2:4 |
| D.2:3:5 |
您最近一年使用:0次
2022-01-26更新
|
783次组卷
|
19卷引用:吉林省松原市重点高中2021-2022学年高一3月联考化学试题
吉林省松原市重点高中2021-2022学年高一3月联考化学试题山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(实验班)试题山西省朔州市应县第一中学2019届高三9月月考化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期开学考试化学试题湖南省张家界市民族中学2019-2020学年高一上学期第三次月考化学试题浙江省宁波市慈溪中学2019届高三化学二轮复习:化学计算2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】安徽省合肥一六八中学2019-2020学年高一下学期入学考试化学试题人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 易错疑难集训辽宁省大连市金普新区2020-2021学年高一下学期开学检测化学试题(苏教版2019)必修第二册专题9 金属与人类文明 B 素养拓展区安徽省合肥市部分学校2021-2022学年高一上学期期末考试化学试题安徽省合肥市第六中学2021-2022学年高一上学期期末考试化学试题福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题江西省吉安市宁冈中学2020-2021学年高三上学期开学考试化学试题陕西省西安市第八十九中学2022-2023学年高一下学期开学考试化学试题湖南省永州市第一中学2022-2023学年高一上学期期末考试化学试题
11-12高二上·浙江嘉兴·期中
9 . 已知在酸性溶液中,下列物质氧化 时,自身发生如下变化:
时,自身发生如下变化: ,
, ,
, ,
,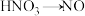 ,如果分别用相同数目的这些微粒氧化足量的
,如果分别用相同数目的这些微粒氧化足量的 ,得到
,得到 最多的是
最多的是
 时,自身发生如下变化:
时,自身发生如下变化: ,
, ,
, ,
,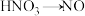 ,如果分别用相同数目的这些微粒氧化足量的
,如果分别用相同数目的这些微粒氧化足量的 ,得到
,得到 最多的是
最多的是A. | B. | C. | D. |
您最近一年使用:0次
2022-01-21更新
|
317次组卷
|
24卷引用:吉林省洮南市第一中学2021-2022学年高一上学期期中考试化学试题
吉林省洮南市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷(已下线)2011-2012学年北京市师大附中高一上学期期中考试化学试卷(已下线)2012-2013学年河北枣强县中学高一上学期期末考试化学试卷(已下线)2014—2015学年甘肃兰州一中高一上学期期中考试化学卷上海交通大学附属中学2016-2017学年高一下学期质量检测一(3月)化学试题山东省曲阜师范大学附属中学2017-2018学年高一上学期期中考试化学试题北京师范大学附属中学2017-2018学年高一上学期期中考试化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】新疆维吾尔自治区生产建设兵团第二中学2018-2019学年高一上学期期中检测化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2018-2019学年高一上学期第二次月考化学试题安徽省阜阳市第三中学2019-2020学年高一上学期第二次调研考试化学试题山西省祁县第二中学校2019-2020学年高一上学期期中考试化学试题四川省三台中学2019-2020学年高一上学期第三次月考化学试题新疆昌吉教育共同体2020-2021学年高一下学期期末质量检测化学试题河北省辛集市第一中学2021-2022学年高一上学期第一次月考化学试题河北省石家庄市第一中学2021-2022学年高一上学期期中考试化学试卷内蒙古呼和浩特市2021-2022学年高一上学期期末考试化学试题内蒙古赤峰二中2021-2022学年高一上学期第二次月考化学试题北京市北京师范大学附属中学2022-2023学年高一上学期期中考试化学试题北京市清华大学附属中学2023-2024学年高一上学期12月统练二化学试题 河北省石家庄市第二中学西校区2023-2024学年高一上学期12月月考化学试题北京师范大学附属中学2023-2024学年高一上学期期中考试化学试题北京市陈经纶中学2023-2024学年高一上学期12月月考化学试卷
名校
解题方法
10 . 某强酸性溶液中可能存在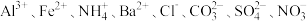 中的若干种,为确定溶液组成进行如下实验:
中的若干种,为确定溶液组成进行如下实验:
(1)取100mL原溶液,加入足量 溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
(2)往(1)所得滤液c中加入足量的NaOH溶液并加热,可得气体d和沉淀e,过滤。
(3)取(2)中过滤所得滤液,通入少量的CO2,有白色沉淀f生成。
下列有关判断正确的是
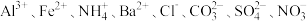 中的若干种,为确定溶液组成进行如下实验:
中的若干种,为确定溶液组成进行如下实验:(1)取100mL原溶液,加入足量
 溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。(2)往(1)所得滤液c中加入足量的NaOH溶液并加热,可得气体d和沉淀e,过滤。
(3)取(2)中过滤所得滤液,通入少量的CO2,有白色沉淀f生成。
下列有关判断正确的是
A.试液中一定没有 |
B.试液中一定有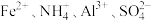 |
| C.气体b和气体d在一定条件下能发生反应生成一种单质和一种无色液体 |
D.沉淀f一定含有 ,可能含有 ,可能含有 |
您最近一年使用:0次
2022-01-19更新
|
1585次组卷
|
7卷引用:吉林省白山市2021-2022学年高三上学期期末考试化学试题
吉林省白山市2021-2022学年高三上学期期末考试化学试题广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题(已下线)卷04离子共存-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)上海交通大学附属中学2021-2022学年高三下学期期中考试化学试题山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)第一部分 二轮专题突破 专题4 离子共存与离子推断黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期1月期末考试化学试题



