名校
解题方法
1 . 某强酸性溶液中可能存在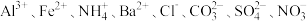 中的若干种,为确定溶液组成进行如下实验:
中的若干种,为确定溶液组成进行如下实验:
(1)取100mL原溶液,加入足量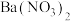 溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
(2)往(1)所得滤液c中加入足量的NaOH溶液并加热,可得气体d和沉淀e,过滤。
(3)取(2)中过滤所得滤液,通入少量的CO2,有白色沉淀f生成。
下列有关判断正确的是
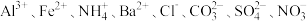 中的若干种,为确定溶液组成进行如下实验:
中的若干种,为确定溶液组成进行如下实验:(1)取100mL原溶液,加入足量
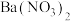 溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。
溶液,有白色沉淀a和无色气体b生成,过滤得滤液c。(2)往(1)所得滤液c中加入足量的NaOH溶液并加热,可得气体d和沉淀e,过滤。
(3)取(2)中过滤所得滤液,通入少量的CO2,有白色沉淀f生成。
下列有关判断正确的是
A.试液中一定没有 |
B.试液中一定有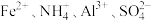 |
| C.气体b和气体d在一定条件下能发生反应生成一种单质和一种无色液体 |
D.沉淀f一定含有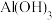 ,可能含有 ,可能含有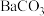 |
您最近一年使用:0次
2022-01-19更新
|
1585次组卷
|
7卷引用:上海交通大学附属中学2021-2022学年高三下学期期中考试化学试题
上海交通大学附属中学2021-2022学年高三下学期期中考试化学试题吉林省白山市2021-2022学年高三上学期期末考试化学试题广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题(已下线)卷04离子共存-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)第一部分 二轮专题突破 专题4 离子共存与离子推断黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期1月期末考试化学试题
2 . 为研究二氧化碳与氢氧化钠溶液的反应,某同学利用压强传感器和 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)

(1)设计实验乙的目的是_______ 。
(2)图丙中曲线_______ (选填“Ⅰ”或“Ⅱ”)表示 和NaOH溶液的反应。
和NaOH溶液的反应。
(3)两烧瓶中的压强在开始阶段均增大的原因是_______ 。
该同学利用下图所示装置测定上述实验甲中反应后烧瓶内溶液中碳酸钠的质量分数。
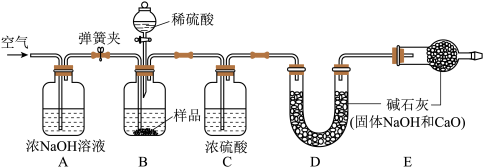
(4)实验需要以下步骤:
①称量装置D的质量为304.6g;
②取10g实验甲烧瓶内反应后的溶液装入装置B中;
③连接装置,检查装置气密性;
④打开弹簧夹,缓缓鼓入一段时间空气:
⑤再次称量D的质量为307.9g;
⑥打开弹簧夹a,再次缓缓鼓入一段时间空气;
⑦关闭弹簧夹a,滴加稀硫酸使其发生反应,直至不再产生气泡为止;
写出以上步骤的正确顺序_______ (用步骤编号表示)。
(5)E装置的作用是_______ 。
(6)打开弹簧夹a,再次缓缓鼓入一段时间空气的目的是_______ 。
(7)根据相关数据,图甲反应后烧瓶内溶液中碳酸钠的质量分数为_______ 。
 传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
传感器设计了如图甲、乙两个实验装置,甲的注射器中装有过量的NaOH溶液,乙的注射器中装有等体积的水,实验时将两装置注射器中的液体全部推入烧瓶中,试验后,得到了压强随时间变化的曲线(如图丙)
(1)设计实验乙的目的是
(2)图丙中曲线
 和NaOH溶液的反应。
和NaOH溶液的反应。(3)两烧瓶中的压强在开始阶段均增大的原因是
该同学利用下图所示装置测定上述实验甲中反应后烧瓶内溶液中碳酸钠的质量分数。

(4)实验需要以下步骤:
①称量装置D的质量为304.6g;
②取10g实验甲烧瓶内反应后的溶液装入装置B中;
③连接装置,检查装置气密性;
④打开弹簧夹,缓缓鼓入一段时间空气:
⑤再次称量D的质量为307.9g;
⑥打开弹簧夹a,再次缓缓鼓入一段时间空气;
⑦关闭弹簧夹a,滴加稀硫酸使其发生反应,直至不再产生气泡为止;
写出以上步骤的正确顺序
(5)E装置的作用是
(6)打开弹簧夹a,再次缓缓鼓入一段时间空气的目的是
(7)根据相关数据,图甲反应后烧瓶内溶液中碳酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1291次组卷
|
9卷引用:上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题
4 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
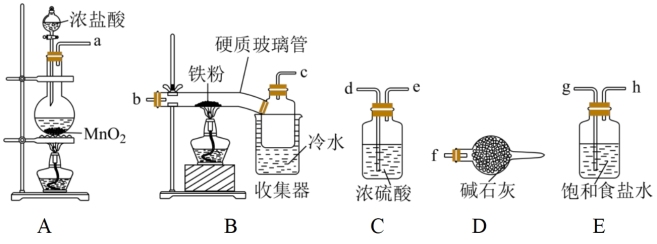
(1)装置接口的连接顺序为a→_______ 。
(2)B中收集器里盛放冷水的作用是_______ 。D中碱石灰的作用是_______ 、_______ 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去
①试剂X为_______ (填化学式)。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_______ 。
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明_______ ;
b.另一份滴加试剂X,溶液出现红色,说明_______ ;
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明_______ 。
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是_______ ;得出结论:_______ 。

(1)装置接口的连接顺序为a→
(2)B中收集器里盛放冷水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸,充分反应后,进行如下实验:
固体混合物
 淡黄色溶液
淡黄色溶液 淡红色溶液
淡红色溶液 深红色溶液
深红色溶液 红色褪去
红色褪去①试剂X为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是
(4)该小组同学对上述溶液红色褪去的原因进行探究。
①取褪色后的溶液三份,分别进行以下实验,研究溶液中存在的微粒。
a.一份中滴加FeCl3溶液无明显变化,说明
b.另一份滴加试剂X,溶液出现红色,说明
c.还有一份滴加稀盐酸和BaCl2溶液,产生白色沉淀,说明
②另取FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。实验②的目的是
您最近一年使用:0次
2022-07-02更新
|
1040次组卷
|
3卷引用:上海市控江中学2021-2022学年高一下学期期末考试化学试题
14-15高三上·安徽·阶段练习
名校
解题方法
5 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
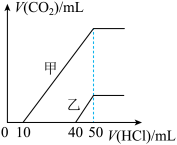

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2623次组卷
|
25卷引用:上海市十二校2015届高三12月联考化学试题
上海市十二校2015届高三12月联考化学试题(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州市三校2021-202学年高一上学期期末联考化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省南充高级中学2021-2022学年高一下学期开学考试化学试题陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
6 . I.氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用
)是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。某同学在实验室中对
。某同学在实验室中对 与
与 反应进行了探究。回答下列问题:
反应进行了探究。回答下列问题:
(1)将20mL 和NO的混合气体通入倒立于水槽且盛满水的试管中,充分反应后试管中剩余10mL气体,则原混合气体中
和NO的混合气体通入倒立于水槽且盛满水的试管中,充分反应后试管中剩余10mL气体,则原混合气体中 与NO的体积比为_______。
与NO的体积比为_______。
(2)如果选择A装置制备氨气,写出对应的化学反应方程式_______ 若使用B装置制备氨气;请简单说明氨气制备的原料_______ 和反应原理(用化学方程式表示)_______ ;收集氨气时用D装置,气体从_______ 进入(填e或f)。欲制取一瓶干燥的氨气,除发生装置外,还需选择图中的C装置进行干燥,其中干燥剂应使用_______ 。
氨气的制备
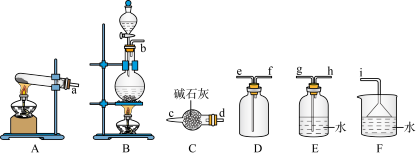
II.氨气与二氧化氮的反应:将上述收集到的 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子、
(两端用夹子、 夹好)。在一定温度下按下图所示装置进行实验(加热装置和夹持装置省略)。
夹好)。在一定温度下按下图所示装置进行实验(加热装置和夹持装置省略)。

(3)打开 ,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中
,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中_______ ,Y管中反应的化学方程式为:_______ 。
(4)Z的作用为_______ 。
III.硝酸和硝酸盐是化工中的重要原料
(5) 受热易分解,分解反应为:
受热易分解,分解反应为: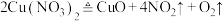 。某学生将带火星的木条放入
。某学生将带火星的木条放入 受热分解得到的混合气体中,木条复燃。则下列判断正确的是_______。
受热分解得到的混合气体中,木条复燃。则下列判断正确的是_______。
(6)1.52g铜镁合金完全溶解于足量浓硝酸中,得到标况下 和
和 的混合气体1120mL。(已知室温下,生成的
的混合气体1120mL。(已知室温下,生成的 有一部分会自发二聚生成四氧化二氮,
有一部分会自发二聚生成四氧化二氮,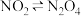 ),向反应后的溶液中加入1.0mol/L NaOH 溶液,当金属离子全部沉淀时,得到2.54g沉淀;则该合金中
),向反应后的溶液中加入1.0mol/L NaOH 溶液,当金属离子全部沉淀时,得到2.54g沉淀;则该合金中 =
=_______ ; 和
和 的混合气体中,
的混合气体中, 的体积分数为
的体积分数为_______ 。
 )是大气污染物之一,工业上在一定温度和催化剂条件下用
)是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。某同学在实验室中对
。某同学在实验室中对 与
与 反应进行了探究。回答下列问题:
反应进行了探究。回答下列问题:(1)将20mL
 和NO的混合气体通入倒立于水槽且盛满水的试管中,充分反应后试管中剩余10mL气体,则原混合气体中
和NO的混合气体通入倒立于水槽且盛满水的试管中,充分反应后试管中剩余10mL气体,则原混合气体中 与NO的体积比为_______。
与NO的体积比为_______。| A.1:1 | B.1:3 | C.3:1 | D.2:1 |
氨气的制备

II.氨气与二氧化氮的反应:将上述收集到的
 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子、
(两端用夹子、 夹好)。在一定温度下按下图所示装置进行实验(加热装置和夹持装置省略)。
夹好)。在一定温度下按下图所示装置进行实验(加热装置和夹持装置省略)。
(3)打开
 ,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中
,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中(4)Z的作用为
III.硝酸和硝酸盐是化工中的重要原料
(5)
 受热易分解,分解反应为:
受热易分解,分解反应为: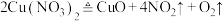 。某学生将带火星的木条放入
。某学生将带火星的木条放入 受热分解得到的混合气体中,木条复燃。则下列判断正确的是_______。
受热分解得到的混合气体中,木条复燃。则下列判断正确的是_______。| A.产物中有氧气,所以木条复燃 | B.不能确定 是否助燃 是否助燃 |
C. 肯定也能助燃 肯定也能助燃 | D. 肯定不能助燃 肯定不能助燃 |
 和
和 的混合气体1120mL。(已知室温下,生成的
的混合气体1120mL。(已知室温下,生成的 有一部分会自发二聚生成四氧化二氮,
有一部分会自发二聚生成四氧化二氮,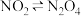 ),向反应后的溶液中加入1.0mol/L NaOH 溶液,当金属离子全部沉淀时,得到2.54g沉淀;则该合金中
),向反应后的溶液中加入1.0mol/L NaOH 溶液,当金属离子全部沉淀时,得到2.54g沉淀;则该合金中 =
= 和
和 的混合气体中,
的混合气体中, 的体积分数为
的体积分数为
您最近一年使用:0次
7 . 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.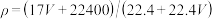 |
B.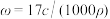 |
C.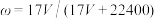 |
D. =1000Vρ/(17V+22400) =1000Vρ/(17V+22400) |
您最近一年使用:0次
2016-12-09更新
|
4931次组卷
|
130卷引用:上海实验高中2021-2022学年高一上学期第一次测试化学试题
上海实验高中2021-2022学年高一上学期第一次测试化学试题上海市黄浦区大同中学2021-2022学年高一上学期期中考试化学试题上海外国语大学附属外国语学校松江云间中学2021-2022学年高一上学期10月测试化学试题上海市浦东新区上海中学东校2022-2023学年高一上学期第一次阶段性素质评估化学试题上海市实验学校2021-2022学年高一上学期第一次测试化学试题2010年普通高等学校招生全国统一考试理综化学部分(四川卷)2010年高考化学试题分项专题三 物质的量2010年高考化学试题分项专题十四 化学计算(已下线)2010年重庆一中高一下学期期末考试化学试题(已下线)2010年四川省成都七中高一上学期期中考试化学试卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2010—2011学年辽宁省营口市高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高一10月份月考化学试卷(已下线)2011-2012年辽宁省开原高中高一上学期第一次考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷(已下线)2011-2012学年湖北省黄冈中学高一上学期期中考试化学试卷(已下线)2011-2012学年海南省琼海市嘉积中学高一上学期教学质量检测化学试卷(已下线)2011-2012学年甘肃省兰州市兰炼一中高一上学期期中考试化学试卷(已下线)2011-2012学年四川省成都市树德协进中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2015届广西桂林市第十八中学高三上学期第一次月考化学试卷(已下线)2014-2015学年浙江嘉兴第一中学高一10月月考化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届广西桂林市第十八中学高三第一次月考化学试卷2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷2015-2016学年广东省普宁一中高一上学期第三次月考化学试卷2015-2016学年四川省双流中学高一下入学考试化学试卷2015-2016学年广西桂林十八中高二下开学测化学试卷2015-2016学年河北省保定市高一上学期期末化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷2017届湖北省大冶一中高三上学期8月月考化学试卷2017届福建省南安一中高三暑假阶段性考试化学试卷2016-2017学年宁夏育才中学高一上第一次月考化学试卷2016-2017学年河南省南阳一中高一上第一次月考化学卷2016-2017学年河北省定州二中高一上10月月考化学试卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题一对接高考精练--物质的量浓度及其溶液的配制山西省忻州市第一中学2016-2017学年高一必修一:第1章从实验学化学同步练习化学试题河南省南阳市第一中学2018届高三上学期第二次考试化学试题江西省新余市第一中学2018届高三毕业年级第二次模拟考试化学试题江西省崇义中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市实验中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市第一中学2017-2018学年高一上学期第一次阶段性检测化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一上学期第一次验收考试化学试题新疆阿克苏市农一师中学2017-2018学年高一上学期第一次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第一次月考化学试题天津市静海县第一中学2018届高三9月学生学业能力调研考试化学试题河南省中原名校(即豫南九校)2017-2018学年高一上学期期中联考化学试题安徽省定远重点中学2017-2018学年高一上学期期末考试化学试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题湖北省黄冈中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】江西省新余市第一中学2017-2018学年高二下学期第三次段考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期末考试化学试题黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题(已下线)解密02 化学常用计量——备战2018年高考化学之高频考点解密安徽省肥东县高级中学2019届高三上学期8月调研考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测2018--2019高中化学《物质的量浓度》专项训练题【全国百强校】新疆维吾尔自治区乌鲁木齐市第一中学2019届高三上学期第一次月考(9月)化学试题湖南省岳阳县第一中学、汨罗市一中2018-2019学年高一上学期10月联考化学试题河南省豫西名校2018-2019学年高一上学期第一次联考化学试题湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题河南省永城高中2018-2019学年高一上学期第一次月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高一上学期10月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一上学期10月模块诊断化学试题【全国百强校】辽宁省实验中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题【全国百强校】内蒙古自治区乌兰察布市集宁区第一中学2018-2019学年高一上学期期末考试化学试题河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题贵州省铜仁第一中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.2 物质的量浓度(讲)-《2020年高考一轮复习讲练测》吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题黑龙江省鹤岗市第一中学2019-2020学年高一第一次月考化学试题河南省林州市第一中学2019-2020学年高一10月月考化学试题安徽省六安市舒城中学2019-2020学年高一上学期第一次月考化学试题2020届高三化学一轮复习 基本概念物质的量(过关检测)山西运城市康杰中学2019-2020学年高一上学期期中考试化学试题四川省遂宁市第二中学2019-2020学年高一上学期期中考试化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高一上学期期中考试化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高一上学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一上学期第三次月考化学试题2020届高三化学化学二轮复习——高考常考题:质量分数、物质的量浓度的相关计算【精编25题】广西壮族自治区来宾市金秀县民族中学2019-2020学年高一上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广西壮族自治区来宾市忻城县民族中学2019-2020学年高一上学期期末考试化学试题黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题(已下线)2.2.2化学反应的计算 练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第1单元 化学计量在实验中的应用(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷鲁科版(2019)高一必修第一册第1章 认识化学科学 总结检测高一必修第一册(鲁科2019)第1章第3节 化学中常用的物理量——物质的量广东省深圳市外国语学校2021届高三第一次月考化学试题陕西省渭南高级中学2019-2020学年高一上学期第一次月考化学试题山西大学附属中学2020-2021学年高上学期10月月考化学试题四川省成都外国语学校2020-2021学年高一上学期10月月考化学试题甘肃省天水市第一中学2020-2021学年高一上学期第一学段考试化学试题(已下线)【新东方】【2019】【高一上】【期中考】【JEZ】【化学】【栾子豪制作】(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题山西省太原市山西大学附属中学2020-2021学年高一上学期10月(总第一次)模块诊断化学试题四川省遂宁市射洪中学校2020-2021学年高一上学期第一次月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题江西省上饶市横峰中学2020-2021学年高一上学期期中考试化学试题内蒙古自治区赤峰市第二实验中学2020-2021学年高一上学期10月月考化学试题四川省广元市川师大万达中学2020-2021学年高一上学期期中考试化学试题甘肃省天水市第三中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw72江西省南昌市八一中学、洪都中学等七校2020-2021学年高一上学期期末联考化学试题(已下线)专题03 溶液——备战2021年高考化学纠错笔记黑龙江省鹤岗市第一中学2020-2021学年高二下学期期中考试化学试题(已下线)专题02 物质的量在化学实验中的应用(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)四川省遂宁市射洪中学2021-2022学年高一上学期第一次月考化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题广东省湛江市第二十一中学2022届高三9月第二次月考化学试题辽宁省实验中学分校2017-2018学年高一上学期期中考试化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题黑龙江省大庆中学2021-2022学年高一上学期期末考试化学试题北京市汇文中学2021-2022学年高一上学期期末考试化学试卷(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)2.2.2 物质的量浓度相关计算(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题黑龙江省实验中学2022-2023学年高一上学期期中测试化学试题甘肃省兰州第一中学2023-2024学年高一上学期12月月考化学试题
8 . 某校两个化学兴趣小组完成关于氯气的实验。
小组1为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。请按要求回答下列问题:
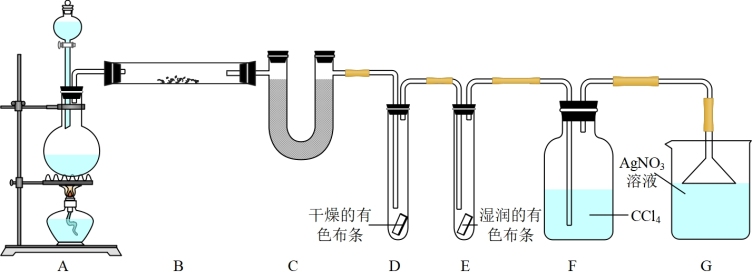
(1)写出烧瓶中发生反应的化学方程式____ 。
(2)装置B中盛放的试剂名称是____ ,作用是____ ,C中试剂名称是____ 。
(3)结合离子方程式解释装置D和E出现的不同现象的原因____ 。
(4)AgNO3溶液的作用是____ 、____ 。
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置____ 之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为____ 。
A.湿润的淀粉碘化钾试纸 B.浓硫酸
C.湿润的红色布条 D.饱和食盐水
(6)A装置中分液漏斗内所用溶液浓度为11.8mol/L,现欲用其配制100mL0.6mol/L的稀溶液。则需量取____ mL浓溶液,量取所用量筒的规格是____ (选填“10mL”、“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是____ 。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
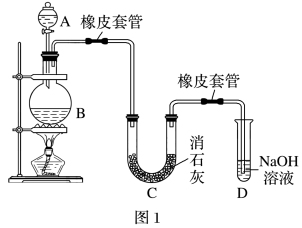
小组2设计了如图1装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),结果实验所得Ca(ClO)2产率太低。经查阅资料发现主要原因是U形管中存在两个副反应。
(7)温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____ ,有同学测出了反应后溶液中Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图2(不考虑氯气和水的反应)。
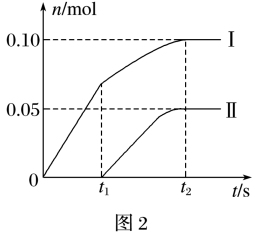
(8)图2中曲线Ⅱ表示____ 的物质的量随反应时间变化的关系,判断的理由是____ 。
(9)另取一份含有1molCa(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为1.2mol,则产物中n(ClO—):n(ClO )=
)=____ 。
(10)试判断U形管中另一个副反应是(写出该反应的化学方程式)____ ;改进措施是____ 。
小组1为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。请按要求回答下列问题:

(1)写出烧瓶中发生反应的化学方程式
(2)装置B中盛放的试剂名称是
(3)结合离子方程式解释装置D和E出现的不同现象的原因
(4)AgNO3溶液的作用是
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置
A.湿润的淀粉碘化钾试纸 B.浓硫酸
C.湿润的红色布条 D.饱和食盐水
(6)A装置中分液漏斗内所用溶液浓度为11.8mol/L,现欲用其配制100mL0.6mol/L的稀溶液。则需量取
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
小组2设计了如图1装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),结果实验所得Ca(ClO)2产率太低。经查阅资料发现主要原因是U形管中存在两个副反应。

(7)温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是

(8)图2中曲线Ⅱ表示
(9)另取一份含有1molCa(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为1.2mol,则产物中n(ClO—):n(ClO
 )=
)=(10)试判断U形管中另一个副反应是(写出该反应的化学方程式)
您最近一年使用:0次
解题方法
9 . Na2CO3和NaHCO3是重要的无机化工产品,广泛应用于食品、化工、医药等领域。如图是利用天然碱(主要成分为Na2CO3、NaHCO3和少量NaCl)制备Na2CO3和NaHCO3的工艺流程。
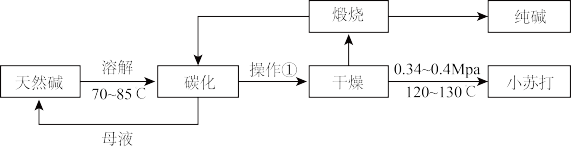
完成下列填空:
(1)操作①为___ 。
(2)碳化装置中反应的离子方程式___ 。
(3)解释选择0.34~0.4MPa干燥的原因___ 。
(4)对比索尔维制碱法,说明利用天然碱制碱的优势___ 。
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称____ 。
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是___ ,此时滴定终点的现象为___ 。
③计算该样品中NaHCO3的质量分数为____ 。

完成下列填空:
(1)操作①为
(2)碳化装置中反应的离子方程式
(3)解释选择0.34~0.4MPa干燥的原因
(4)对比索尔维制碱法,说明利用天然碱制碱的优势
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是
③计算该样品中NaHCO3的质量分数为
您最近一年使用:0次
10 . 一定量的某磁黄铁矿(主要成分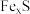 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是
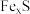 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是A. | B.生成了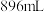 气体 气体 |
C. | D.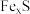 中, 中, |
您最近一年使用:0次
2022-12-16更新
|
433次组卷
|
2卷引用: 上海市闵行区2022-2023学年高三上学期一模质量调研化学试题

 、
、 、
、 、
、
 、
、 、
、 、
、


