名校
解题方法
1 . 下列实验中,对应的操作、现象以及结论都正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向KI—淀粉溶液中滴加氯水 | 溶液变成蓝色 | 还原性:Cl->I- |
| B | 向蒸馏水中滴入几滴酚酞溶液,再加入过氧化钠观察现象 | 产生气泡,且溶液变红 | 过氧化钠与水反应生成O2和NaOH |
| C | 将潮湿的氯气通过盛有干燥红纸条的集气瓶 | 纸条红色褪去 | 氯气具有漂白性 |
| D | 向CuSO4溶液中加入一小块钠 | 产生无色气泡,溶液底部有蓝色沉淀生成 | Na不会直接与溶液中的CuSO4反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-26更新
|
4598次组卷
|
12卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
西藏拉萨中学2022届高三第七次月考理综化学试题河北正中实验中学2021-2022学年高一上学期期中考试化学试题河北省石家庄市第二中学南校区2021-2022学年高一上学期12月月考化学试题(已下线)2022年全国甲卷高考真题变式题(选择题)(已下线)2022年全国乙卷高考变式题(选择题)(已下线)2022年浙江1月高考真题变式题(21-25)湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题吉林省长春市博硕学校(原北京师范大学长春附属学校)2022-2023学年高一上学期期中考试化学试题辽宁省沈阳市第五中学2022-2023学年高一上学期期末考试化学试题湖北省襄阳市第五中学2022-2023学年高一上学期12月月考化学试题陕西省西安市高新第一中学2021-2022学年高一上学期期末考试化学试题湖北省荆州市沙市中学2022-2023学年高一上学期12月月考化学试题
2 . 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5mol FeS2发生反应,有10mol电子转移 |
C.产物中的SO 离子有一部分是氧化产物 离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
您最近一年使用:0次
2021-01-12更新
|
1911次组卷
|
41卷引用:【全国百强校】西藏自治区拉萨北京实验中学2019届高三上学期第二次月考化学试题
【全国百强校】西藏自治区拉萨北京实验中学2019届高三上学期第二次月考化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2010年安徽省合肥八中高三上学期第二次月考化学试题(已下线)2012届浙江省杭州市高复高三上学期11月份月考化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷2016届重庆市巫山中学高三第一次质量检测化学试卷2016届辽宁省葫芦岛市高三上学期期末调研化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷2015-2016学年湖南省长沙长郡中学高一上期末化学试卷2016-2017学年安徽省合肥一中高一上开学测化学试卷2017届陕西省西安市第七十中学高三上学期10月月考化学试卷2017届河北辛集中学高三上理综测试三化学试卷2017届河北省定州中学高三上期中化学试卷12016-2017学年安徽省铜陵一中高一12月月考化学试卷广东省化州市2018届高三上学期第一次高考模拟考试理综化学试题辽宁省大连育明高级中学、本溪市高级中学2018届高三10月月考化学(理)试题江苏省无锡市普通高中2017-2018学年高一上学期期末考试化学试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题福建省华安一中、长泰一中等四校2017-2018学年高一下学期第一次(4月)联考化学试题(已下线)2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 讲【全国百强校】陕西省西安市第一中学2019届高三上学期第一次月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第四次调研考试化学试题【全国百强校】山东省临沂市蒙阴县实验中学2019届高三上学期第二次月考(12月)化学试题吉林省白城市第一中学2018-2019学年高一上学期12月月考化学试题福建省福州市八县一中2020届高三年上学期期中联考化学试题广东省深圳市实验中学2019-2020学年高一上学期期中考试化学试题安徽省滁州市定远县育才学校2019-2020学年高一(普通班)上学期第三次月考化学试题甘肃省武威第十八中学2021届高三上学期第四次诊断检测(期末)化学试题专题3 第一单元 第3课时 氧化还原反应-高中化学苏教2019版必修第一册(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州市格致中学2022-2023学年高三上学期期中模拟测试化学试题山西省山西大学附属中学2022-2023学年高一上学期期中考试化学试题 新疆乌鲁木齐八一中学2023-2024学年高一上学期期中考试化学试卷
名校
解题方法
3 . 现有NaHCO3和Na2CO3的混合物,为了测定二者的质量,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量 )。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。
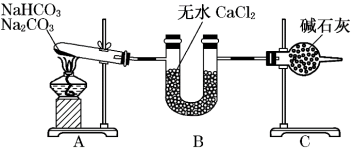
(1)B装置的作用是____ 。
(2)C装置的作用是____ 。
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为____ g。
(4)A装置中发生反应的化学方程式为:____ 。
(5)请通过计算,判断m的取值范围____ 。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。

(1)B装置的作用是
(2)C装置的作用是
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为
(4)A装置中发生反应的化学方程式为:
(5)请通过计算,判断m的取值范围
您最近一年使用:0次
解题方法
4 . 氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
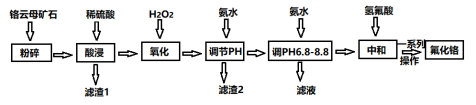
下表列出了相关金属离子生成氢氧化物沉淀的pH:
(1)将铬云母矿石粉碎的目的是___________ 。
(2)滤渣1主要成分的用途是___________ 。(写一种)
(3)“氧化”步骤能否省略___________ (填“是”或“否”),你的依据是___________ 。
(4)Cr2O3与稀硫酸反应的离子方程式为___________ 。
(5)第一次滴加氨水调节pH范围为___________ 。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___________ ;Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________ 。

下表列出了相关金属离子生成氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
| 沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
(1)将铬云母矿石粉碎的目的是
(2)滤渣1主要成分的用途是
(3)“氧化”步骤能否省略
(4)Cr2O3与稀硫酸反应的离子方程式为
(5)第一次滴加氨水调节pH范围为
(6)第二次滴加氨水调节pH为6.8~8.8的目的是
您最近一年使用:0次
5 . 某化学小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁(Fe2O3),并进行铁含量的测定。主要操作步骤如下:
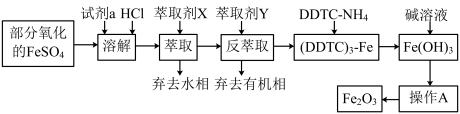
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH 。
。
请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式_________ 。
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的___ 放气;为提高萃取率和产品产量,实验时应进行的操作是__________ 。
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)____ 。
(4)操作A为_____ 、_____ 、______ 。产品处理时,温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图所示,则温度最好控制在______ ℃。

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用______ (填仪器名称)移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定,消耗K2Cr2O7溶液20.60mL。产品中铁的含量为______ (假设杂质不与K2Cr2O7反应)。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH
 。
。请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)
(4)操作A为

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用
您最近一年使用:0次
2020-07-28更新
|
389次组卷
|
6卷引用:西藏拉萨中学2021届高三上学期第五次月考化学试题
解题方法
6 . 从铝土矿(主要成分Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图:

(1)固体A的主要成分为___ ;固体X的主要成分有__ 。
(2)写出流程乙加入烧碱后Al2O3发生的离子方程式:___ 。
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___ (填化学式)。
(4)写出灼烧步骤发生的化学反应方程式:___ 。
(5)滤液E、K中溶质的主要成分是___ (填化学式),写出该溶液的一种用途:___ 。

(1)固体A的主要成分为
(2)写出流程乙加入烧碱后Al2O3发生的离子方程式:
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入
(4)写出灼烧步骤发生的化学反应方程式:
(5)滤液E、K中溶质的主要成分是
您最近一年使用:0次
2021-03-15更新
|
171次组卷
|
2卷引用:西藏林芝市第二高级中学2021届高三上学期第五次月考理综化学试题
7 . 纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________ 。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2_____________________________________ (用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________ 。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是______________________ 。
(5)甲装置中仪器a的名称为_______________________ 。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______ (用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________ (结果保留三位有效数字)。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2
(3)生成纳米级Fe的化学方程式为
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是
(5)甲装置中仪器a的名称为
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
丙同学认为乙同学的结论不正确,他的理由是
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为
您最近一年使用:0次
2018-01-18更新
|
507次组卷
|
5卷引用:西藏自治区拉萨中学2018届高三第七次月考理综化学试题
名校
解题方法
8 . (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是 ____________________ 。
(2)为防止氯气尾气污染空气,可用__________________ 溶液吸收多余的氯气。
(3)漂白粉是常用的消毒剂。
① 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为______________________ 。
② 漂白粉的有效成分是(填化学式)__________________________________ 。
③ 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学方程式为____ 。
④长期露置于空气中的漂白粉,加稀盐酸后产生的气体是____________ (填编号)。
A.O2 B.Cl2 C.CO2 D.HClO

(2)为防止氯气尾气污染空气,可用
(3)漂白粉是常用的消毒剂。
① 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为
② 漂白粉的有效成分是(填化学式)
③ 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学方程式为
④长期露置于空气中的漂白粉,加稀盐酸后产生的气体是
A.O2 B.Cl2 C.CO2 D.HClO
您最近一年使用:0次
9 . 分A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第_______ 周期______ 族。
(2)C和E两元素相比较,非金属性较强的是__________ (填元素名称),可以验证该结论的是_________________ (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的离子方程式:___________________ 。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式为___________ ;
(5)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为__________ 。
请回答下列问题:
(1)D位于元素周期表第
(2)C和E两元素相比较,非金属性较强的是
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的离子方程式:
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式为
(5)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素的元素符号:① ______ ,⑥______ ,⑦ _______ ,⑨______ 。
(2)画出下列微粒的结构示意图:④的原子:____________ ,⑧的离子:___________ 。
(3)表中的12种元素中,金属性最强的元素是________ ,非金属性最强的元素是_________ ,最不活泼的元素是_______ 。(均填元素符号)
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是______ (填元素符号)。元素③和⑦可以形成 _____________ (填“离子”或“共价”)化合物。
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式____________ 。
族 周期 | IA | IIA | IIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出下列微粒的结构示意图:④的原子:
(3)表中的12种元素中,金属性最强的元素是
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式
您最近一年使用:0次



