1 . 下列化学用语正确的是
A.甲烷的结构式: | B.乙烷的结构简式; |
C.四氯化碳的电子式: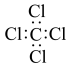 | D.甲基的电子式: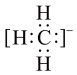 |
您最近半年使用:0次
名校
解题方法
2 . 下列有关化学用语表示正确的是
A.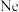 和 和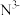 的结构示意图均为: 的结构示意图均为: | B.叠氮酸钠的分子式是: |
C.氨气的空间填充模型: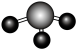 | D.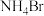 的电子式: 的电子式: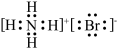 |
您最近半年使用:0次
3 . 探究硝酸银溶液对氯水漂白性的影响
资料:i.次氯酸盐具有一定的漂白性,但比HClO漂白性弱。
ii.相同条件下,还原性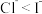 。
。
iii.溶解度较大的沉淀可以转化为溶解度较小的沉淀。
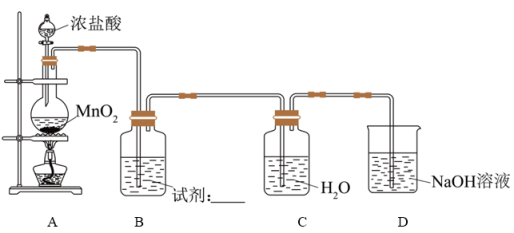
Ⅰ.氯水的制备装置如图所示:
(2)A中反应的离子方程式是___________ 。
(3)B中试剂是___________ 。
(4)结合离子方程式表示D中NaOH溶液的作用是___________ 。
Ⅱ.探究氯水与 溶液的反应
溶液的反应
(5)实验①的目的是排除稀释对品红褪色的影响,故试剂a是___________ 。
实验①的目的是排除稀释对品红褪色的影响,所以需要加入水实
(6)根据②中品红褪色慢的现象,推测发生复分解反应___________ (填化学方程式)生成AgClO沉淀,导致②中HClO减少,白色沉淀为AgCl和AgClO的混合物。
资料:i.次氯酸盐具有一定的漂白性,但比HClO漂白性弱。
ii.相同条件下,还原性
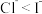 。
。iii.溶解度较大的沉淀可以转化为溶解度较小的沉淀。
Ⅰ.氯水的制备装置如图所示:
| A.新制氯水中还有三种分子、四种离子 |
| B.氯水颜色呈现出浅黄绿色 |
| C.取一滴久置氯水蘸在pH试纸上,pH试纸不变色 |
| D.取少量的新制氯水加入淀粉碘化钾溶液,观察到溶液变蓝 |
(2)A中反应的离子方程式是
(3)B中试剂是
(4)结合离子方程式表示D中NaOH溶液的作用是
Ⅱ.探究氯水与
 溶液的反应
溶液的反应| 序号 | 向1mL氯水中加入 | 现象 |
| ① | 试剂a+1滴品红 | 几秒后品红褪色 |
| ② | 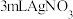 溶液+1滴品红 溶液+1滴品红 | 产生白色沉淀,几分钟后品红褪色 |
(5)实验①的目的是排除稀释对品红褪色的影响,故试剂a是
实验①的目的是排除稀释对品红褪色的影响,所以需要加入水实
(6)根据②中品红褪色慢的现象,推测发生复分解反应
您最近半年使用:0次
名校
4 . 配平方程式并标出电子转移方向及数目___________ 。
___________ ___________
___________ ___________
___________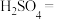 ___________
___________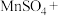 ___________
___________ ___________
___________ ___________
___________
___________
 ___________
___________ ___________
___________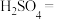 ___________
___________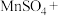 ___________
___________ ___________
___________ ___________
___________
您最近半年使用:0次
名校
5 . 下列叙述正确的
A.区别 和葡萄糖的方法是熔融状态下能否导电 和葡萄糖的方法是熔融状态下能否导电 |
B. 中含有共价键,所以 中含有共价键,所以 属于共价化合物 属于共价化合物 |
| C.非金属元素组成的化合物中只含共价键 |
| D.某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键 |
您最近半年使用:0次
解题方法
6 . 特殊的分散系——胶体
把一种或多种物质分散在另一种物质中所得到的体系称为分散系,接照分散质的大小可将分散系分为溶液、胶体和浊液三类。三者之间无明显界限。胶体是物质的一种分散状态,比较稳定,外观上胶体溶液不浑浊,用肉眼或普通显微镜均不能辨别。很多蛋白质、淀粉、血液、淋巴液等都属于胶体。胶体还可以按照分散剂的状态分为固溶胶如有色玻璃、气溶胶如雾、烟和液溶胶如FeOH3胶体。1.胶体可以稳定存在的主要原因是______。
| A.胶体粒子直径在1~100nm之间 | B.胶体具有丁达尔现象 |
| C.胶粒带电 | D.胶体外观均匀 |
| A.在豆浆中加入盐卤做豆腐 |
| B.河流入海处易形成沙洲 |
| C.一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路 |
| D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
| A.蛋白质溶液 | B.氨水 | C.食盐水 | D.酒精溶液 |
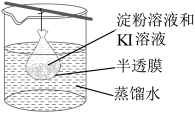
5.在小烧杯中加入20mL蒸馏水加热煮沸后,向沸水申滴入几滴饱和的FeCl3溶液,继续煮沸至溶液呈色即制得FeOH3胶体。
①写出上述胶体制备的化学反应方程式
②取制得的FeOH3胶体装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,说明氢氧化铁胶粒带
③另取制得的FeOH3胶体于洁净的试管中,向其中逐滴滴加过量稀硫酸,边滴边振荡,观察到的现象是
您最近半年使用:0次
解题方法
7 . 一定物质的量浓度溶液的配制
某化学小组需要480mL0.1000mol/L的NaOH溶液,欲在实验室用固体烧碱配制。请回答下列问题:Mm=40g/mol1.用
2.将氢氧化钠放入
3.静置、冷却,将溶液转移至
4.配制过程中,还需要用到的仪器填写代号__________。
| A.量筒 | B.冷凝管 | C.胶头滴管 | D.漏斗 |
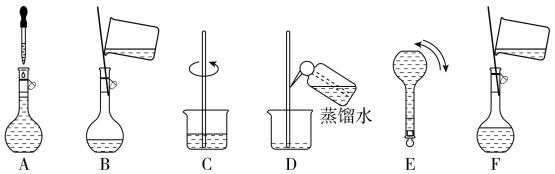
①将NaOH溶液转移到容量瓶时,不慎有少许溶液洒在容量瓶外
②转移前,容量瓶中含有少量蒸馏水
③定容时,俯视刻度线
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
7.实验过程中若用浓度为18.4mol/L的浓硫酸配制250mL0.5mol/L的稀硫酸,则需要取用浓硫酸
您最近半年使用:0次
解题方法
8 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为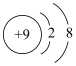 |
C.O的电子式: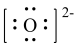 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近半年使用:0次
名校
9 . 下列物质中属于电解质的是
| A.稀硫酸 | B.硫酸钡 | C.盐酸 | D.氨水 |
您最近半年使用:0次
10 . 烧水壶中的水垢主要成分是碳酸钙和氢氧化镁,可以用食醋浸泡去除水垢,写出醋酸的电离方程式___________ ,反应中醋酸与碳酸钙发生的离子方程式___________ 。
您最近半年使用:0次



