1 . 利用废铝箔(主要成分为 ,含少量
,含少量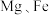 等)制明矾
等)制明矾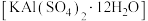 的一种工艺流程如下:
的一种工艺流程如下:
 ,含少量
,含少量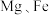 等)制明矾
等)制明矾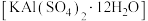 的一种工艺流程如下:
的一种工艺流程如下: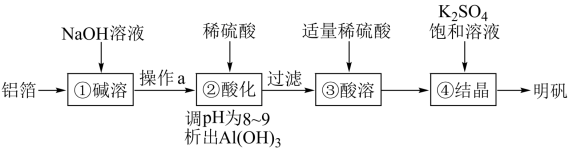
A.①中生成了 : :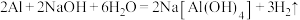 |
B.操作 是过滤,以除去难溶于 是过滤,以除去难溶于 溶液的杂质 溶液的杂质 |
| C.②③中加入稀硫酸的作用均是除去杂质 |
D.由④可知,室温下明矾的溶解度小于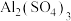 和 和 的溶解度 的溶解度 |
您最近半年使用:0次
名校
2 . 近年来,利用SRB(硫酸盐还原菌)治理废水中的有机物、 及重金属污染取得了新的进展。
及重金属污染取得了新的进展。
(1)图1表示 和
和 在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样
在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样 ,在SRB的作用下,废水中的有机物(主要为
,在SRB的作用下,废水中的有机物(主要为 )将
)将 还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:
还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:____________ 。 还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。______ 。
②负极附近的 的变化:
的变化:______ (“减小”或“增大”)。
(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将 转化为
转化为 除去,转化过程中有单质生成。完成第一步反应的离子方程式。
除去,转化过程中有单质生成。完成第一步反应的离子方程式。
第一步________
______ ______
______ _______+______↓+______
_______+______↓+______
第二步:
 及重金属污染取得了新的进展。
及重金属污染取得了新的进展。(1)图1表示
 和
和 在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样
在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样 ,在SRB的作用下,废水中的有机物(主要为
,在SRB的作用下,废水中的有机物(主要为 )将
)将 还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:
还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化: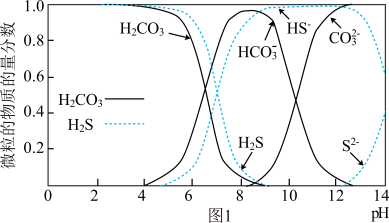
 还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
②负极附近的
 的变化:
的变化:(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将
 转化为
转化为 除去,转化过程中有单质生成。完成第一步反应的离子方程式。
除去,转化过程中有单质生成。完成第一步反应的离子方程式。第一步
______
 ______
______ _______+______↓+______
_______+______↓+______
第二步:

您最近半年使用:0次
名校
3 . 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与 混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和
混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和 ,
,
①浓盐酸与 混合加热生成氯气的离子方程式为
混合加热生成氯气的离子方程式为______ ;
②电极反应式:
ⅰ.还原反应:
ⅱ.氧化反应:____________ 。
③根据电极反应式,分析A中仍存在盐酸和 的原因。
的原因。
ⅰ.随 降低或
降低或 升高,
升高, 氧化性减弱。
氧化性减弱。
ⅱ.随 降低,
降低,____________ 。
④补充实验证实了③中的分析。
a是______ ,b是______ 。
(2)利用 对
对 氧化性的影响,探究卤素离子的还原性。
氧化性的影响,探究卤素离子的还原性。
相同浓度的KCl、KBr和KI溶液,能与 反应所需的最低
反应所需的最低 由大到小的顺序是
由大到小的顺序是____________ ,从原子结构角度说明理由____________ 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将 氧化为
氧化为 。经实验证实了推测。该化合物是
。经实验证实了推测。该化合物是____________ 。
(4)总结:物质氧化性和还原性变化的一般规律是____________ 。
(1)浓盐酸与
 混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和
混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和 ,
,①浓盐酸与
 混合加热生成氯气的离子方程式为
混合加热生成氯气的离子方程式为②电极反应式:
ⅰ.还原反应:

ⅱ.氧化反应:
③根据电极反应式,分析A中仍存在盐酸和
 的原因。
的原因。ⅰ.随
 降低或
降低或 升高,
升高, 氧化性减弱。
氧化性减弱。ⅱ.随
 降低,
降低,④补充实验证实了③中的分析。
序号 | 实验 | 加入试剂 | 现象 |
Ⅰ |
| 较浓硫酸 | 有氯气 |
Ⅱ | a | 有氯气 | |
III | a和b | 无氯气 |
(2)利用
 对
对 氧化性的影响,探究卤素离子的还原性。
氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与
 反应所需的最低
反应所需的最低 由大到小的顺序是
由大到小的顺序是(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将
 氧化为
氧化为 。经实验证实了推测。该化合物是
。经实验证实了推测。该化合物是(4)总结:物质氧化性和还原性变化的一般规律是
您最近半年使用:0次
名校
解题方法
4 . X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子K层和L层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,R的一种氧化物能使品红溶液褪色,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)X的最高价氧化物的电子式为______ ;
(2)X、Y、Z、W的原子半径由大到小的顺序:____________ (用元素符号表示)。
(3)元素W在周期表的位置______ ,其最高价氧化物对应水化物与R的最高价氧化物对应水化物(酸性或碱性)强弱是______ (用化学式表示)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为____________ 。
(1)X的最高价氧化物的电子式为
(2)X、Y、Z、W的原子半径由大到小的顺序:
(3)元素W在周期表的位置
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为
您最近半年使用:0次
名校
5 . 有下列物质:① ②
② ③
③ ④NaOH⑤
④NaOH⑤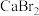 ⑥
⑥ 请回答下列问题:
请回答下列问题:
(1)只含有离子键的化合物有______ (填序号,下同):
(2)既含有极性键又含有非极性键的共价化合物有______ ;
 ②
② ③
③ ④NaOH⑤
④NaOH⑤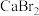 ⑥
⑥ 请回答下列问题:
请回答下列问题:(1)只含有离子键的化合物有
(2)既含有极性键又含有非极性键的共价化合物有
您最近半年使用:0次
名校
6 . 下列化学用语不正确的是
A. 的电子式: 的电子式: |
B.S的原子结构示意图: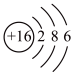 |
C.KOH的电离方程式: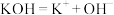 |
D.用电子式表示HCl的形成过程: |
您最近半年使用:0次
7 . 某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
注:实验中c(KMnO4) = 0.01 mol·L-1。
下列说法不正确 的是
| 序号 | 试剂 | 实验现象 |
| ① | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水+0.5 mL蒸馏水 | 溶液完全褪色所需时间:③<②<①。实验均产生棕褐色固体(经检验为MnO2),都伴有少量气泡产生(经检验为N2)。 |
| ② | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1稀硫酸 | |
| ③ | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1 Na2SO4溶液 | |
| ④ | 2 mL KMnO4溶液 + 1 mL 5 mol·L-1 (NH4)2SO4溶液 + 0.5 mL蒸馏水 | 无明显变化 |
下列说法
A.实验①中发生了反应2 MnO + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O |
B.溶液完全褪色所需时间② < ①的主要原因:c(H+)增大,MnO 的氧化性增强 的氧化性增强 |
C.对比实验③④可得出,还原性:NH3 > NH |
| D.在实验④的试剂中,逐滴加入浓NaOH溶液,可观察到溶液褪色 |
您最近半年使用:0次
名校
解题方法
8 . 下列有关化学用语表述不正确的是
A.中子数为16的硫原子: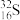 |
B. 的电子式: 的电子式: |
C.氨气的结构式: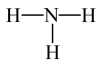 |
D.由Na和Cl形成NaCl的过程: |
您最近半年使用:0次
昨日更新
|
128次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
9 . 利用废铝箔(主要成分为 ,含少量
,含少量 等)制明矾
等)制明矾 的一种工艺流程如下:
的一种工艺流程如下:
下列说法中,不正确 的是
 ,含少量
,含少量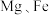 等)制明矾
等)制明矾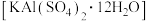 的一种工艺流程如下:
的一种工艺流程如下:
下列说法中,
| A.操作a是过滤 |
B.步骤②中用 代替稀硫酸也可以得到 代替稀硫酸也可以得到 |
C.步骤③所得溶液中含有的离子只有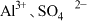 |
D.由④可推测,室温下明矾的溶解度小于 和 和 的溶解度 的溶解度 |
您最近半年使用:0次
7日内更新
|
87次组卷
|
2卷引用:北京市中国人民大学附属中学2023-2024学年高一下学期第一次练习化学试题
10 . 在Pt-BaO催化下,NO的“储存-还原”过程如图1所示。其中“还原”过程依次发生反应Ⅰ和反应Ⅱ,各气体的物质的量变化如图2所示。
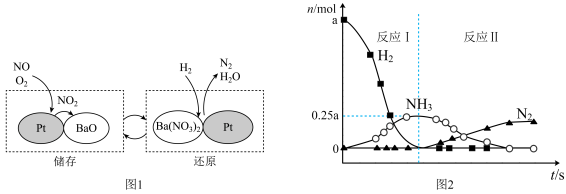
A. 与BaO的反应中, 与BaO的反应中, 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
B.反应Ⅰ为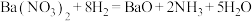 |
C.反应Ⅱ中,最终生成 的物质的量为0.2a mol 的物质的量为0.2a mol |
D.反应Ⅰ和Ⅱ中消耗的 的质量比是3∶5 的质量比是3∶5 |
您最近半年使用:0次




