名校
解题方法
1 . 某温度下,将氯气Cl2通入氢氧化钾溶液中,发生反应为:Cl2+KOH-KCl+KClO+KClO3+H2O(未配平),得到KCl,KClO,KCO3的混合液,经测定溶液中ClO-与ClO 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为| A.23:7 | B.7:23 | C.12:7 | D.7:12 |
您最近一年使用:0次
2023-10-13更新
|
1078次组卷
|
6卷引用:吉林省辉南县2023-2024学年第六中学高一上学期11月半月考化学试卷
名校
解题方法
2 . 13.6gFe和Fe2O3的混合物,加入150mL足量的稀硫酸,在标准状况下收集到1.12LH2,向反应后的溶液中滴入KSCN溶液不变红。为中和过量的H2SO4,并使Fe元素恰好全部转化为Fe(OH)2沉淀,恰好消耗了200mL3mol/L的NaOH溶液(忽略溶液体积变化)。下列说法正确的是
| A.混合物中Fe2O3的物质的量为0.1mol |
| B.混合物中Fe的物质的量为0.5mol |
| C.原硫酸的浓度为2mol/L |
| D.与固体粉末反应的硫酸的物质的量为0.6mol |
您最近一年使用:0次
2023-03-13更新
|
378次组卷
|
3卷引用:吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取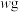 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
519次组卷
|
7卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
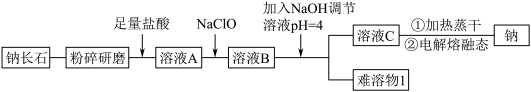
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
525次组卷
|
6卷引用:吉林省松原市2022-2023学年高一上学期期中化学试题
5 . 铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
您最近一年使用:0次
2022-10-29更新
|
608次组卷
|
3卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
名校
解题方法
6 . 草酸亚铁晶体(FeC2O4•2H2O)常用作生产锂电池、涂料、着色剂以及感光材料的原材料,难溶于水,受热易分解。
I.制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol•L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸腾停止加热,静置;
③待黄色晶体FeC2O4•2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

(1)B的名称是____ ;B的出水口是____ (填“上口”或“下口”)。
(2)硫酸亚铁铵晶体中可能混有Fe3+,检验其是否含有Fe3+的试剂是____ 溶液,若混有Fe3+,观察到的现象是____ 。
II.将一定质量的草酸亚铁晶体(FeC2O4•2H2O)在氩气气氛中进行热重分析示意图(TG%表示残留固体质量占原样品总质量的百分数)。

(3)B处时残留物的化学式为____ 。
(4)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为____ 。
I.制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol•L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸腾停止加热,静置;
③待黄色晶体FeC2O4•2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。

(1)B的名称是
(2)硫酸亚铁铵晶体中可能混有Fe3+,检验其是否含有Fe3+的试剂是
II.将一定质量的草酸亚铁晶体(FeC2O4•2H2O)在氩气气氛中进行热重分析示意图(TG%表示残留固体质量占原样品总质量的百分数)。

(3)B处时残留物的化学式为
(4)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为
您最近一年使用:0次
2022-10-29更新
|
177次组卷
|
4卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
名校
解题方法
7 . 向Fe2O3和铁粉的混合物中加入适量稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1,那么该反应中Fe2O3、Fe、H2SO4的物质的量之比为
| A.1:1:1 |
| B.1:2:3 |
| C.1:2:4 |
| D.2:3:5 |
您最近一年使用:0次
2022-01-26更新
|
783次组卷
|
19卷引用:吉林省松原市重点高中2021-2022学年高一3月联考化学试题
吉林省松原市重点高中2021-2022学年高一3月联考化学试题山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(实验班)试题山西省朔州市应县第一中学2019届高三9月月考化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期开学考试化学试题湖南省张家界市民族中学2019-2020学年高一上学期第三次月考化学试题浙江省宁波市慈溪中学2019届高三化学二轮复习:化学计算2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】安徽省合肥一六八中学2019-2020学年高一下学期入学考试化学试题人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 易错疑难集训辽宁省大连市金普新区2020-2021学年高一下学期开学检测化学试题(苏教版2019)必修第二册专题9 金属与人类文明 B 素养拓展区安徽省合肥市部分学校2021-2022学年高一上学期期末考试化学试题安徽省合肥市第六中学2021-2022学年高一上学期期末考试化学试题福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题江西省吉安市宁冈中学2020-2021学年高三上学期开学考试化学试题陕西省西安市第八十九中学2022-2023学年高一下学期开学考试化学试题湖南省永州市第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
8 . 某实验小组研究刻蚀电路板以及刻蚀废液的性质,下列实验对应的离子方程式书写正确的是
A.用盐酸双氧水刻蚀铜板: |
B.用 溶液刻蚀铜板: 溶液刻蚀铜板: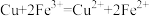 |
C.检验废液中含有 : :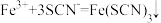 |
D.用酸性 检验 检验 : :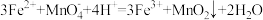 |
您最近一年使用:0次
2021-08-04更新
|
3810次组卷
|
11卷引用:吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题
吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题广东省2022届高三8月阶段性质量检测化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)卷03 离子方程式正误判断-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押广东卷化学第15题 离子方程式正误判断-备战2022年高考化学临考题号押题(广东卷)(已下线)2022年广东卷高考真题变式题(11-16)江苏省响水中学2021-2022学年高一下学期第三次学情分析考试化学试题(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)湖南省永州市第一中学2022-2023学年高三上学期入学考试化学试题江西省丰城市第九中学2021-2022学年高三上学期第一次月考(日新部)化学试题陕西省西安市蓝田县城关中学大学区联考2023-2024学年高一上学期1月期末化学试题
9 . 在实验室采用如图装置制备气体,合理的是
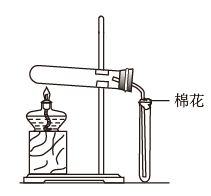
| 化学试剂 | 制备的气体 | |
| A | 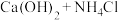 |  |
| B | 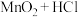 (浓) (浓) |  |
| C | 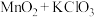 |  |
| D | 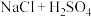 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21816次组卷
|
50卷引用:吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题(已下线)第3讲 物质制备实验的设计与评价章末知识整合黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题
名校
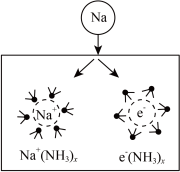
10 . 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是

| A.钠的密度比液氨大 |
| B.溶液的导电性增强 |
| C.钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ |
| D.0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol电子 |
您最近一年使用:0次
2021-05-07更新
|
1591次组卷
|
15卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题山东省临沂市部分县区2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题(已下线)课时14 钠及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题浙江省湖州市三贤联盟2021-2022学年高一上学期期中考试化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题



