名校
解题方法
1 . 某溶液可能含 和
和 中的某几种。探究小组为了确定该溶液中离子的组成,取
中的某几种。探究小组为了确定该溶液中离子的组成,取 该溶液进行实验(溶液密度为
该溶液进行实验(溶液密度为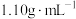 )。
)。
(1)填写下面实验报告中的空格:
(2)步骤三发生反应的离子方程式为___________ 。
(3)上述实验还不能确定是否存在的离子是___________ 。
 和
和 中的某几种。探究小组为了确定该溶液中离子的组成,取
中的某几种。探究小组为了确定该溶液中离子的组成,取 该溶液进行实验(溶液密度为
该溶液进行实验(溶液密度为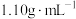 )。
)。(1)填写下面实验报告中的空格:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀 | 原溶液中肯定有 ,肯定无 ,肯定无 | 肯定无该离子的理由是 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到 黑色固体 黑色固体 | 原溶液中 的质量分数为 的质量分数为 |  元素守恒 元素守恒 |
| 步骤三 | 向步骤二的滤液中加足量稀硝酸和 溶液,得到白色沉淀,过滤 溶液,得到白色沉淀,过滤 | 原溶液中肯定有 | 肯定无 的理由是 的理由是 |
| 步骤四 | 向步骤三的滤液中加足量稀硝酸和 溶液,得到白色沉淀 溶液,得到白色沉淀 | 原溶液中肯定有 | 白色沉淀的化学式为 |
(3)上述实验还不能确定是否存在的离子是
您最近一年使用:0次
2024-01-21更新
|
78次组卷
|
2卷引用:湖南省衡阳市衡阳县第四中学2023-2024学年高一上学期10月月考化学试卷
名校
解题方法
2 . 根据下列装置图回答问题(装置图用符号表示):
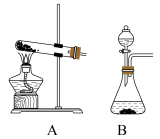
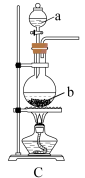
(1)装置C图中,b所指的玻璃仪器的名称为___________ 。
(2)用锌粒和稀硫酸反应制取氢气应选用的气体发生装置为___________ (填A、B或C,下同),相应的离子方程式为___________ 。
(3)实验室利用KClO3在MnO2作催化剂时,加热可以制得氧气,应选用的气体发生装置是___________ ,相应的化学方程式为___________ ,用双线桥标出电子转移方向和数目:___________ 。


(1)装置C图中,b所指的玻璃仪器的名称为
(2)用锌粒和稀硫酸反应制取氢气应选用的气体发生装置为
(3)实验室利用KClO3在MnO2作催化剂时,加热可以制得氧气,应选用的气体发生装置是
您最近一年使用:0次
名校
解题方法
3 . 化学上用分类法学习化学物质的共性,用比较法学习化学物质的特性,物质的氧化性与还原性尤为重要。回答下列问题:
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知:H3PO3+2NaOH(过量)=Na2HPO3+2H2O。H3PO3属于___________ (填“一”“二”或“三”)元酸。Na2HPO3属于___________ (填“正盐”或“酸式盐”)。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式。___________
______Fe(OH)3+______CH4+______H+ ______Fe2++______HCO
______Fe2++______HCO +_______。
+_______。
(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O,写出该反应的离子方程式
、H+和H2O,写出该反应的离子方程式___________ 。
(4)NaBH4(B为+3价)常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 mol NaBH4的还原能力相当于___________ mol H2的还原能力。ClO2是一种新型消毒剂,其消毒效率(单位质量得电子的能力)是Cl2的___________ 倍。(保留2位小数)
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知:H3PO3+2NaOH(过量)=Na2HPO3+2H2O。H3PO3属于
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式。
______Fe(OH)3+______CH4+______H+
 ______Fe2++______HCO
______Fe2++______HCO +_______。
+_______。(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 、H+和H2O,写出该反应的离子方程式
、H+和H2O,写出该反应的离子方程式(4)NaBH4(B为+3价)常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 mol NaBH4的还原能力相当于
您最近一年使用:0次
4 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ:在用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:
①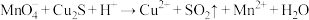 (未配平)
(未配平)
②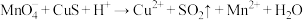 (未配平)
(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mol
d.还原性的强弱关系是: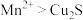
Ⅱ:在稀硫酸中, 与也能发生氧化还原反应。
与也能发生氧化还原反应。
(2)配平 与
与 反应的离子方程式:
反应的离子方程式:___________

(3)欲配制480mL0.1mol/L 溶液,需称取
溶液,需称取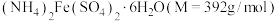 的质量为
的质量为___________ g,需要的玻璃仪器有___________ 。
Ⅲ:实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和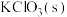 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:
(4)用软锰矿制备 的化学方程式是:
的化学方程式是:___________ 。
(5) 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为___________ 。
Ⅰ:在用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:①
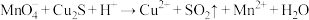 (未配平)
(未配平)②
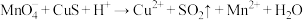 (未配平)
(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)
 ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mold.还原性的强弱关系是:
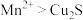
Ⅱ:在稀硫酸中,
 与也能发生氧化还原反应。
与也能发生氧化还原反应。(2)配平
 与
与 反应的离子方程式:
反应的离子方程式:
(3)欲配制480mL0.1mol/L
 溶液,需称取
溶液,需称取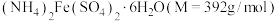 的质量为
的质量为Ⅲ:实验室可由软锰矿(主要成分为
 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和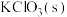 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:(4)用软锰矿制备
 的化学方程式是:
的化学方程式是:(5)
 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
5 . 按要求填空。
(1)反应 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,___________ (填分子式,下同)是氧化剂,___________ 是还原产物。
(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:___________ (填“氧化性”或“还原性”)。
(3)已知有 ,
,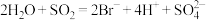 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ 。
(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:________
___________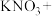 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH
(5)元素G的一种含氧酸化学式为 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物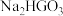 为
为___________ (填“酸式盐”或“正盐”)。
(1)反应
 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将
 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:(3)已知有
 ,
,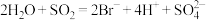 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将
 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:___________
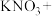 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH(5)元素G的一种含氧酸化学式为
 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物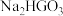 为
为
您最近一年使用:0次
解题方法
6 . 妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是________(填字母)。
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
相同质量的碳酸钠与碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是________ 。
(3)小餐实际操作时,发现面团发得不好;面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸煮后果然蒸出了松软的馒头。该过程中NaHCO3发生的反应,其化学反应方程式为________ 。
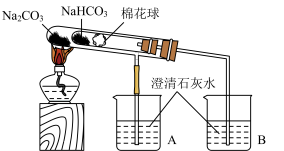
(4)用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
实验时,观察小试管内棉花球上的无水硫酸铜颜色变化是________ 。烧杯________ (填“A”或“B”)中澄清石灰水变浑浊。
若将大小试管中的Na2CO3和NaHCO3位置互换,________ (填“能”或“不能”)得出相同的实验结论。
(1)下列关于纯碱的认识正确的是________(填字母)。
| A.受热易分解 | B.水溶液显碱性 | C.属于碱 | D.可与酸反应。 |
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
相同质量的碳酸钠与碳酸氢钠与足量的盐酸反应,消耗盐酸较多的是
(3)小餐实际操作时,发现面团发得不好;面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸煮后果然蒸出了松软的馒头。该过程中NaHCO3发生的反应,其化学反应方程式为
(4)用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
实验时,观察小试管内棉花球上的无水硫酸铜颜色变化是
若将大小试管中的Na2CO3和NaHCO3位置互换,

您最近一年使用:0次
解题方法
7 . 某课外活动小组进行 胶体的制备实验并检验其性质。
胶体的制备实验并检验其性质。
(1)胶体是一种重要的分散系。制备 胶体是向煮沸的蒸馏水中逐滴加入
胶体是向煮沸的蒸馏水中逐滴加入________ (填入“NaOH溶液”或“饱和FeCl3溶液”)溶液,继续煮沸至液体呈________ 色,停止加热。
(2)区分胶体和溶液常用的方法叫________ 。
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
(4)高铁酸钠( )是一种新型绿色消毒剂:
)是一种新型绿色消毒剂: 在处理饮用水的过程中铁元素会被转化为
在处理饮用水的过程中铁元素会被转化为 ,进而
,进而 在水中产生
在水中产生 胶体,
胶体, 胶体具有吸附性。
胶体具有吸附性。 在处理饮用水的过程中发生了
在处理饮用水的过程中发生了________ (填“氧化还原”或“非氧化还原”)反应。 中铁元素价态为
中铁元素价态为________ 。利用 胶体的吸附性净水,该过程为
胶体的吸附性净水,该过程为________ (填“物理”或“化学”)变化。
 胶体的制备实验并检验其性质。
胶体的制备实验并检验其性质。(1)胶体是一种重要的分散系。制备
 胶体是向煮沸的蒸馏水中逐滴加入
胶体是向煮沸的蒸馏水中逐滴加入(2)区分胶体和溶液常用的方法叫
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A. 胶体粒子的直径在1~100mm之间 胶体粒子的直径在1~100mm之间 |
B. 胶体具有丁达尔效应 胶体具有丁达尔效应 |
C. 胶体是均一的分散系 胶体是均一的分散系 |
D. 胶体的分散质能透过滤纸 胶体的分散质能透过滤纸 |
 )是一种新型绿色消毒剂:
)是一种新型绿色消毒剂: 在处理饮用水的过程中铁元素会被转化为
在处理饮用水的过程中铁元素会被转化为 ,进而
,进而 在水中产生
在水中产生 胶体,
胶体, 胶体具有吸附性。
胶体具有吸附性。 在处理饮用水的过程中发生了
在处理饮用水的过程中发生了 中铁元素价态为
中铁元素价态为 胶体的吸附性净水,该过程为
胶体的吸附性净水,该过程为
您最近一年使用:0次
解题方法
8 . 对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。如:纯净物根据其组成和性质可进行如下分类。

(1)如图所示的分类方法属于________ 。
(2)某化学兴趣小组对下列四组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.Na2CO3、NaNO3、AgNO3、NaNO2
C.FeCl3溶液、蒸馏水、CaCO3悬浊液、 胶体
胶体
D.NaOH、KOH、 、Fe2O3
、Fe2O3
填写下列空白:
(3)在下列化学物质物质中
①NaCl溶液 ②钠 ③熔融BaSO4 ④CO2 ⑤稀H2SO4 ⑥ 胶体 ⑦蔗糖能导电的电解质是(用字母序号填空)
胶体 ⑦蔗糖能导电的电解质是(用字母序号填空)________ 。非电解质的是________ 。写出⑤与 溶液反应的
溶液反应的离子方程式 ________ 。

(1)如图所示的分类方法属于
(2)某化学兴趣小组对下列四组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.Na2CO3、NaNO3、AgNO3、NaNO2
C.FeCl3溶液、蒸馏水、CaCO3悬浊液、
 胶体
胶体D.NaOH、KOH、
 、Fe2O3
、Fe2O3填写下列空白:
A组 | B组 | C组 | D组 | |
分类标准 | 含氧酸 | 分散系 | ||
不属于该类别的物质 | AgNO3 | Fe2O3 |
(3)在下列化学物质物质中
①NaCl溶液 ②钠 ③熔融BaSO4 ④CO2 ⑤稀H2SO4 ⑥
 胶体 ⑦蔗糖能导电的电解质是(用字母序号填空)
胶体 ⑦蔗糖能导电的电解质是(用字母序号填空) 溶液反应的
溶液反应的
您最近一年使用:0次
名校
9 . I.利用铁元素“价﹣类”二维图可以从不同角度研究含铁物质的性质及其转化关系,请据此图回答问题:
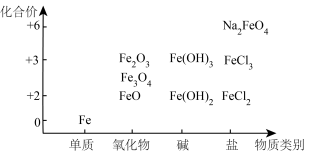
(1)从物质类别和元素价态视角,下列说法中错误的一项是___________
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式___________ 。某研究人员向上述印刷电路板的废液中加入一定量铁粉,充分反应后,准备过滤并收集滤渣。此时,滤渣的成分不可能是___________ 。
A.没有滤渣 B.有Cu也有Fe C.只有Fe D.只有Cu
II.某学习小组设计了一系列实验,研究FeCl2与FeCl3溶液的性质。
(3)请补充空缺的实验现象:
(4)请写出实验1中第一步所发生反应的离子方程式___________ 。

(1)从物质类别和元素价态视角,下列说法中错误的一项是___________
| A.Na2FeO4具有强氧化性,可以用作水体消毒剂 |
| B.FeO和Fe2O3可分别与水发生反应生成Fe(OH)2和Fe(OH)3 |
| C.可以在FeCl2溶液中放入少量Fe粉,以防止溶液变质 |
| D.可以将Al单质作为还原剂和Fe2O3冶炼Fe单质 |
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式
A.没有滤渣 B.有Cu也有Fe C.只有Fe D.只有Cu
II.某学习小组设计了一系列实验,研究FeCl2与FeCl3溶液的性质。
(3)请补充空缺的实验现象:
| 序号 | 实验 | 操作现象 |
| 实验1 | 第一步:取2mL酸化的FeCl2溶液于试管中,加入5滴5%H2O2溶液 | 溶液立即变为棕黄色,稍后产生气泡 |
| 第二步:向反应后的溶液中滴入 | 溶液变为血红色 | |
| 实验2 | 取5mLKI﹣淀粉溶液于试管中,加入2mL酸化的FeCl3溶液 |
(4)请写出实验1中第一步所发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.请根据题目要求,写出下列反应的离子方程式。
(1)向 溶液中加入NaOH溶液离子方程式:
溶液中加入NaOH溶液离子方程式:___________ 。
(2)将碳酸氢钠溶液与稀盐酸混合离子方程式:___________ 。
(3)湿法炼铜,曾青得铁化为铜的离子方程式:___________ 。
Ⅱ.有一瓶透明澄清的溶液,其中可能含有 、
、 、
、 、
、 、
、 ,取该溶液进行以下实验:
,取该溶液进行以下实验:
①取pH试纸检验,测得溶液呈强酸性。
②另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,有白色沉淀产生。
请回答下列问题:
(4)用pH试纸检验,表明溶液呈强酸性,可以排除___________ 的存在。
(5)步骤②中产生白色沉淀的离子方程式为___________ 。
(6)该溶液中可能存在的离子为___________ ,请设计实验验证该离子是否存在:___________ 。
(7)根据上述实验事实能确定溶液中肯定存在的离子是___________ 。
(1)向
 溶液中加入NaOH溶液离子方程式:
溶液中加入NaOH溶液离子方程式:(2)将碳酸氢钠溶液与稀盐酸混合离子方程式:
(3)湿法炼铜,曾青得铁化为铜的离子方程式:
Ⅱ.有一瓶透明澄清的溶液,其中可能含有
 、
、 、
、 、
、 、
、 ,取该溶液进行以下实验:
,取该溶液进行以下实验:①取pH试纸检验,测得溶液呈强酸性。
②另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,有白色沉淀产生。
请回答下列问题:
(4)用pH试纸检验,表明溶液呈强酸性,可以排除
(5)步骤②中产生白色沉淀的离子方程式为
(6)该溶液中可能存在的离子为
(7)根据上述实验事实能确定溶液中肯定存在的离子是
您最近一年使用:0次



