解题方法
1 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
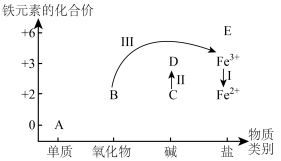
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
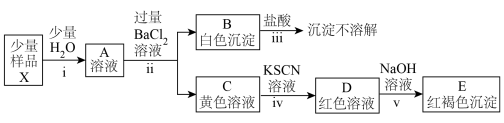
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
2 . 为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)S 在周期表中的位置是___________
(2)下列有关性质的比较,能用元素周期律解释的是___________ (填字母序号)
a.非金属性:O>S b.离子半径:S2->Cl- c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:___________ (用化学式表示),用原子结构解释原因___________
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
能够说明硫元素由+4 价转化为+6 价的证据是___________
(1)S 在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.非金属性:O>S b.离子半径:S2->Cl- c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
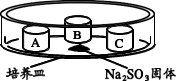 | A | 蘸有品红溶液的棉花 | 品红溶液褪色 |
| B | HCl、BaCl2 的混合溶液 | 无明显变化 | |
| C | HCl、BaCl2、FeCl3 的混合溶液 | 产生白色沉淀 |
能够说明硫元素由+4 价转化为+6 价的证据是
您最近一年使用:0次
2021-02-21更新
|
289次组卷
|
2卷引用:北京市房山区2021届高三上学期期末考试化学试题
解题方法
3 . 同族金属A,B,C具有优良的导热、导电性能,若以I表示电离能,I1最低的是B,(I1+I2低的是A,(I1+I2+I3)最低的是C。
(1)同族元素D,E,F(均为非放射性副族元素)基态原子的价层电子组态符合同一个通式,在元素周期表中,位置在A、B、C所在族之前,请给出D、E、F的元素符号及价层电子组态的通式_______ 。
(2)元素A存在于动物的血蓝蛋白中,人对A元素代谢紊乱可导致Wilson病。
①A2+硫酸盐在碱性溶液中加入缩二脲HN(CONH2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过A的二重旋转轴,无金属一金属键,请画出该阴离子的结构_______ (A必须写元素符号,下同)。
②通过A2+与过量的丁二酮肟形成二聚配合物,实现了A2+的平面正方形配位向A2+的四方锥形配位转化,请画出该配合物的结构_______ (丁二酮肟用N⌒N表示)。
(3)用B+的标准溶液滴定KCl和KSCN的中性溶液,得到电位滴定曲线,其拐点依次位于M、N、P处。
①请分别写出在M、N、P处达到滴定终点的离子反应方程式_______ 、_______ 、_______ 。
②在N处的物质是无支链的聚合物,请至少画出三个单元表示其结构_______ 。
(4)元素C的单质。与单一的无机酸不起作用,但可溶于王水。C与O2和F2作用制得化合物X,在X中C的质量分数为57.43%,X的结构与1962年N。Barlett开创性工作的产物极为相似,通过推演给出X的化学式_______ 。
(1)同族元素D,E,F(均为非放射性副族元素)基态原子的价层电子组态符合同一个通式,在元素周期表中,位置在A、B、C所在族之前,请给出D、E、F的元素符号及价层电子组态的通式
(2)元素A存在于动物的血蓝蛋白中,人对A元素代谢紊乱可导致Wilson病。
①A2+硫酸盐在碱性溶液中加入缩二脲HN(CONH2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过A的二重旋转轴,无金属一金属键,请画出该阴离子的结构
②通过A2+与过量的丁二酮肟形成二聚配合物,实现了A2+的平面正方形配位向A2+的四方锥形配位转化,请画出该配合物的结构
(3)用B+的标准溶液滴定KCl和KSCN的中性溶液,得到电位滴定曲线,其拐点依次位于M、N、P处。
①请分别写出在M、N、P处达到滴定终点的离子反应方程式
②在N处的物质是无支链的聚合物,请至少画出三个单元表示其结构
(4)元素C的单质。与单一的无机酸不起作用,但可溶于王水。C与O2和F2作用制得化合物X,在X中C的质量分数为57.43%,X的结构与1962年N。Barlett开创性工作的产物极为相似,通过推演给出X的化学式
您最近一年使用:0次
4 . 工业上湿法合成硼氢化钠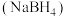 路线如下:
路线如下:

已知:硼酸的结构为: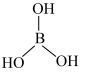
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌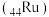 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
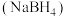 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
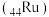 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌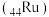 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生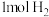 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近一年使用:0次
解题方法
5 . 我国的食品添加剂有多种,如富硒(Se)酵母、二氧化硅、硫黄等,新品种食品添加剂的安全性需通过审查和测试,食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂等,用于食品生产中能更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
(1)二氧化硅是一种新型添加剂,用作抗结剂。硅元素在元素周期表中的位置为___________ ;普通玻璃的主要成分为二氧化硅,用氢氟酸蚀刻普通玻璃时,发生反应的化学方程式为___________ 。
(2)食品添加剂中可能存在的部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如图所示(已知:a为非金属元素)。
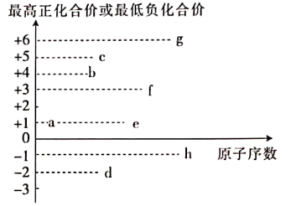
①由a、c、d三种元素形成的离子化合物的化学式为___________ 。
②图中所示元素中金属性最强的是___________ (填元素符号),工业上得到该元素的单质的原理为___________ (填化学方程式)。
③e、f、g元素的简单离子半径由大到小的顺序为___________ (用离子符号回答)。
④低温下,h的单质与化合物eda的稀溶液的反应中的氧化产物为___________ (填化学式)。
⑤a2d2可用于处理碱性工业废水中的bc-,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为___________ 。
(1)二氧化硅是一种新型添加剂,用作抗结剂。硅元素在元素周期表中的位置为
(2)食品添加剂中可能存在的部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如图所示(已知:a为非金属元素)。

①由a、c、d三种元素形成的离子化合物的化学式为
②图中所示元素中金属性最强的是
③e、f、g元素的简单离子半径由大到小的顺序为
④低温下,h的单质与化合物eda的稀溶液的反应中的氧化产物为
⑤a2d2可用于处理碱性工业废水中的bc-,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为
您最近一年使用:0次
2021-11-05更新
|
417次组卷
|
3卷引用:安徽省部分学校2021-2022学年高三上学期10月联考化学试题
安徽省部分学校2021-2022学年高三上学期10月联考化学试题河北省石家庄市保定市2022届高三10月月考化学试题(已下线)解密05 物质结构 元素周期律(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
6 . 我国科学家在金刚石压腔实验中创造出了前所未见的化合物X,在超过113 GPa的压力下能够保持稳定。X在一定条件下完全分解为A(气体)和B,A的密度约为0.18 g·L−1;B是短周期中最活泼的金属;Y为含有C元素的气态氧化物,能使品红溶液褪色,E为常见无机物,Y与E以1∶1发生化合反应生成F,F仅含三种元素,是常用的食品抗氧化剂之一(假设反应过程无损耗,题中均为短周期元素,A、B、C为单质,气体数据均为标准状况下测定)。根据如下转化,回答下列问题:
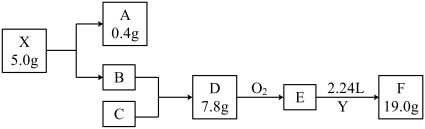
(1) 图中C在元素周期表中的位置是________ 。
(2) D的电子式为________ 。
(3) X的化学式为________ 。
(4) E→F的化学方程式为________ 。

(1) 图中C在元素周期表中的位置是
(2) D的电子式为
(3) X的化学式为
(4) E→F的化学方程式为
您最近一年使用:0次
2019-11-18更新
|
543次组卷
|
3卷引用:浙江省宁波市2020年新高考选考适应性考试化学试题
名校
解题方法
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
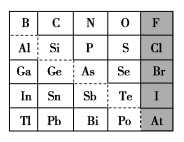
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1569次组卷
|
6卷引用:2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律
解题方法
8 . 从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________ ,由此可知,其最高价氧化物对应的水化物的化学式为:______________ ,次氯酸分子的结构式为:_____________ 。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________ (用离子符号表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式为________________________________ 。
(3)硫和氯的非金属性强弱关系是_________________ ,试从原子结构的角度解释其原因。______________________________________
(4)写出电解饱和食盐水的化学方程式___________________ ,检验氯气生成的方法是_________ 。
(1)Cl在元素周期表中的位置为
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是
(3)硫和氯的非金属性强弱关系是
(4)写出电解饱和食盐水的化学方程式
您最近一年使用:0次
解题方法
9 . 从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________ ,由此可知,其最高价氧化物对应的水化物的化学式 为:______________ ,次氯酸分子的结构式为:_____________ 。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________ (用离子符号 表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式 为____________________________________________________________________________ 。
(3)硫和氯的非金属性强弱关系是_________________ ,试从原子结构的角度解释其原因。______________
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原 性,应选用的试剂有______________ ,看到的现象是 ____________________ 。要证明Na2SO3具有氧化性,应选用的试剂有___________________ ,反应的离子方程式是 ________________________________ 。
(1)Cl在元素周期表中的位置为
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是
(3)硫和氯的非金属性强弱关系是
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 要证明Na2SO3具有还原 性,应选用的试剂有
您最近一年使用:0次
名校
10 . W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________________ (填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________________ 。
②上述实验中,W与足量氯水反应的离子方程式为_________________________________________________________ 。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为___________________ 。
②1mol W与足量水充分反应,转移电子的物质的量为_____________ mol。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为______________________________ 。
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为______________________ ;
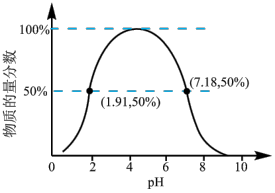
该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈______________________ 。
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为_________________ 。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为
②上述实验中,W与足量氯水反应的离子方程式为
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为
②1mol W与足量水充分反应,转移电子的物质的量为
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为

该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为
您最近一年使用:0次



