1 . 探究铝的性质实验
下列说法不正确 的
Ⅰ | Ⅱ |
 | 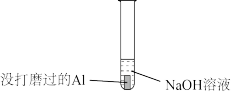 |
| 现象:立即产生气泡 | 现象:开始没气泡一段时间后产生气泡 |
A.从元素化合价角度看,产生的气体只能是 |
B.实验Ⅰ证明 是氧化剂 是氧化剂 |
C.实验Ⅱ说明 具有酸性氧化物的性质 具有酸性氧化物的性质 |
| D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同 |
您最近一年使用:0次
2022-09-02更新
|
383次组卷
|
2卷引用: 北京市平谷区2021-2022学年高一上学期期末考试化学试题
2 . 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
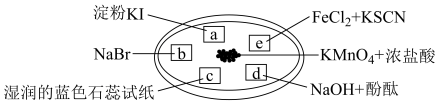
下列说法不正确 的是

下列说法
| A.产生氯气的反应为:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O |
| B.a处变蓝,b处变红棕色,说明氧化性:Cl2>Br2>I2 |
| C.c处先变红,后褪色,证明氯气与水生成酸及具有漂白性的物质 |
| D.d、e处颜色都有改变,反应中消耗等量Cl2时转移的电子数不相同 |
您最近一年使用:0次
2022-10-05更新
|
423次组卷
|
3卷引用:北京市清华大学附属中学2022-2023学年高三9月月考化学试题
解题方法
3 . 下列关于实验Ⅰ~Ⅳ说法不正确 的是
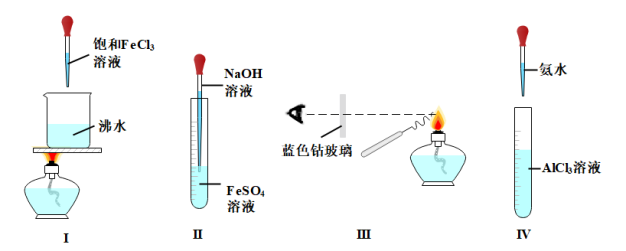

| A.用实验Ⅰ制备Fe(OH)3胶体时,当液体出现红褐色时,应立即停止加热 |
| B.用实验Ⅱ制备Fe(OH)2沉淀,刚开始出现白色沉淀,很快变成灰绿色 |
| C.若实验Ⅲ观察到火焰呈紫色,证明被检验的物质含有钾元素 |
| D.实验Ⅳ观察到的现象是:开始生成白色沉淀,当氨水过量,沉淀消失 |
您最近一年使用:0次
名校
解题方法
4 . 某同学探究铁与水蒸气的反应,进行了如下实验:不正确 的是
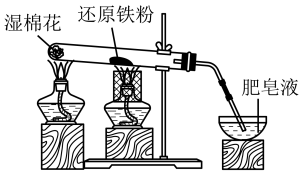
| A.点燃酒精灯的顺序是先a后b |
| B.湿棉花的作用是提供水蒸气 |
| C.由肥皂液冒气泡证明铁与水蒸气发生了反应 |
| D.不能用磁铁将铁粉从反应后的固体中分离出来 |
您最近一年使用:0次
2022-01-19更新
|
302次组卷
|
4卷引用:北京市东城区2021-2022学年高一上学期期末考试化学试题
名校
5 . 某同学进行如下实验:
已知:i.H2O2⇌H++HO 、HO
、HO ⇌H++O
⇌H++O
ii.BaO2是一种白色难溶于水的固体
下列说法合理的是
| 序号 | 实验① | 实验② | 实验③ | 实验④ | 实验⑤ |
| 方案 |  |  |  |  | 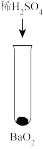 |
| 现象 | 出现白色沉淀 | 无明显现象 | 出现白色沉淀 | 产生大量气泡,高锰酸钾溶液不褪色 | 出现白色沉淀 |
 、HO
、HO ⇌H++O
⇌H++O
ii.BaO2是一种白色难溶于水的固体
下列说法合理的是
| A.实验③可证明H2O2溶液中存在电离平衡 |
| B.实验①和③生成白色沉淀的反应属于氧化还原反应 |
| C.实验⑤的白色沉淀经检验为BaSO4,说明溶解度BaO2>BaSO4 |
| D.可用BaCl2、MnO2、H2O检验长期放置的Na2O2中是否含有Na2CO3 |
您最近一年使用:0次
2022-01-14更新
|
341次组卷
|
5卷引用:北京市丰台区2021-2022学年高三上学期期末考试化学试题
北京市丰台区2021-2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)化学-2022年高考押题预测卷03(北京卷)北京大学附属中学预科部2023-2024学年高三上学期10月阶段练习化学试题北京市中关村中学2023-2024学年高三上学期开学考试化学试卷
名校
解题方法
6 . 研究小组为证明NO2和O2均具有助燃性,用不同可燃物分别在NO2、O2中进行实验,获得如下实验现象。
下列说法不正确 的是
| 可燃物 | NO2 | O2 |
| 带火星的木条 | 5s左右木条熄灭,瓶内石灰水依然澄清 | 5s后木条继续燃烧且有火焰,瓶内石灰水变浑浊 |
| 带火焰的木条 | 木条持续燃烧,火焰变亮,气体红棕色变浅,瓶内石灰水变浑浊 | 木条持续燃烧且更剧烈,火焰变大变亮,瓶内石灰水变浑浊 |
| H2 | 点燃后发出苍白色火焰,瓶口有白雾,迅速将湿润的蓝色石蕊试纸伸向白雾,试纸先变红后褪色,一段时间后内壁有液珠 | 点燃后发出淡蓝色火焰,一段时间后内壁有液珠 |
| A.NO2与C之间、NO2与H2之间均能发生氧化还原反应 |
| B.NO2与C反应比O2与C反应需要更高的温度 |
| C.NO2与H2反应时,蓝色石蕊试纸颜色变化证明二者反应生成了HNO3 |
| D.气体表现助燃性的本质是作为氧化剂参与反应 |
您最近一年使用:0次
2021-03-08更新
|
301次组卷
|
3卷引用:北京市北京师范大学附属实验中学2021-2022学年高一下学期练习卷化学试题
名校
7 . 实验小组研究Na与CO2的反应,装置、步骤和现象如下:

实验步骤和现象:
i. 通入CO2至澄清石灰水变浑浊后,点燃酒精灯。
ii. 一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
iii. 将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv. 将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法不正确 的是

实验步骤和现象:
i. 通入CO2至澄清石灰水变浑浊后,点燃酒精灯。
ii. 一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验CO的试剂未见明显变化。
iii. 将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量BaCl2溶液,产生白色沉淀;再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv. 将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法
| A.步骤i的目的是排除O2的干扰 |
| B.步骤iii证明白色物质是Na2CO3 |
C.步骤iv发生反应的化学方程式为C + 2H2SO4(浓) CO2↑+ 2SO2↑+ 2H2O CO2↑+ 2SO2↑+ 2H2O |
| D.根据以上实验推测:CO2与金属K也可以发生反应并被还原 |
您最近一年使用:0次
2020-11-09更新
|
334次组卷
|
5卷引用:北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题
2020高三·北京·专题练习
名校
解题方法
8 . 某小组同学探究 SO2 与 Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3- Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确的是
 Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)| 实验 | ① | ② | ③ |
| 操作 | 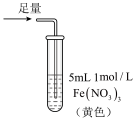 | 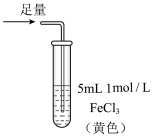 | 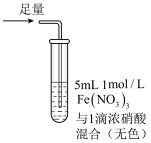 |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率 |
| B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性 |
| D.5h后③比①黄色更深不能证明是 NO3-浓度的增大减慢了SO2与Fe3+反应的速率 |
您最近一年使用:0次
2022·北京·高考真题
9 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
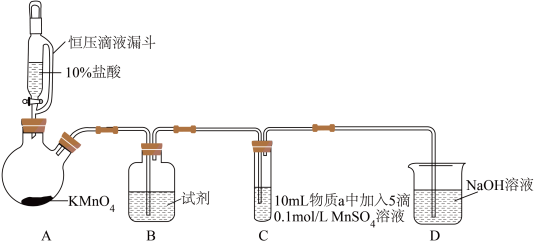
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
815次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
10 . 下列物质性质差异或反应能用元素周期律解释


| A.液氨的沸点高于PH3 | B.如图装置可证明非金属性:Cl>C>Si |
| C.钠单质的密度大于钾 | D.钙与水反应的剧烈程度强于镁 |
您最近一年使用:0次



