解题方法
1 . 下列关于铁及其化合物的说法正确的是
A.将NaOH浓溶液滴加到饱和的 溶液中,制备 溶液中,制备 胶体 胶体 |
B. 溶液常用在印刷电路板将Cu氧化成 溶液常用在印刷电路板将Cu氧化成 , , 被还原为Fe 被还原为Fe |
C.某溶液中加KSCN溶液显红色,证明原溶液中有 ,无 ,无 |
D. 浊液露置于空气中,由白色逐步转变为灰绿色,最后变成红褐色 浊液露置于空气中,由白色逐步转变为灰绿色,最后变成红褐色 |
您最近一年使用:0次
名校
2 . 某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是
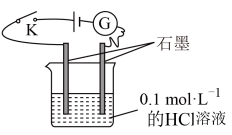

| A.闭合开关K,电流计指针发生偏转,证明HCl是电解质 |
| B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生偏转 |
| C.闭合开关K,向溶液中加入CaCO3固体,电流计示数基本不变 |
| D.选取相同浓度的硫酸替换0.1 mol∙L−1的HCl溶液,电流计的示数相同 |
您最近一年使用:0次
2021-10-27更新
|
473次组卷
|
25卷引用:江苏省靖江高级中学2022-2023学年高一上学期第一次阶段测试化学试题
江苏省靖江高级中学2022-2023学年高一上学期第一次阶段测试化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高一上学期第一次月考化学试题河南省新密市第一高级中学2022-2023学年高一上学期线上测试化学试题四川省江油中学2022-2023学年高一上学期10月月考化学试题2018-2019学年人教版高中化学必修一:18-19 章末综合测评2 化学物质及其变化第2章《元素与物质世界》期中复习检测试卷北京市2019—2020学年高一年级11月月考化学试题湖南省常德市2019-2020学年高一上学期期末考试化学试题山东省滨州市博兴县第三中学2020-2021学年高一上学期10月月考化学试题安徽省六安市第一中学2020-2021学年高一上学期第一次段考化学试题云南省峨山彝族自治县第一中学2020-2021学年高一上学期10月月考化学试题四川省广安市邻水实验学校2020-2021学年高一上学期期中考试化学试题广西壮族自治区桂林市七星区桂林市第十八中学2020-2021学年高一上学期期中考试化学试题河北省泊头市第一中学2020-2021学年高一上学期第三次月考化学试题广东省广州市外国语学校等三校2020-2021学年高一上学期期末联考化学试题重庆市铁路中学2020-2021学年高一上学期1月月考化学试题河北省衡水市第十四中学2021-2022学年高一上学期一调考试(1)化学试题海南省文昌中学2021-2022学年高一上学期第一次月考化学试题河北省石家庄市第一中学2021-2022学年高一上学期第一次学情反馈化学试题2021年北京高考化学试题变式题1-10广西钦州市第四中学2021-2022学年高一上学期期中考试化学试题山西省太原师范学院附属中学、 太原市师苑中学校两校2022-2023 学年高一上学期第一次月考化学试题云南省昆明市禄劝彝族苗族自治县第一中学2021-2022学年高一网络班10月月考化学试题湖南省长沙市长郡中学2023-2024学年高一上学期第一次月考化学试题云南省开远市第一中学校2023-2024学年高一上学期9月月考化学试题
名校
解题方法
3 . 以废旧铅蓄电池中的含铅废料( 、
、 、
、 、
、 及炭黑等)和
及炭黑等)和 为原料,可以制备高纯
为原料,可以制备高纯 ,实现铅的再生利用,其工艺流程如下:
,实现铅的再生利用,其工艺流程如下:
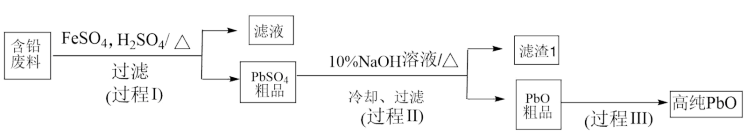
在过程Ⅰ涉及两个反应:
① ;
;
② 。下列说法错误的是
。下列说法错误的是
 、
、 、
、 、
、 及炭黑等)和
及炭黑等)和 为原料,可以制备高纯
为原料,可以制备高纯 ,实现铅的再生利用,其工艺流程如下:
,实现铅的再生利用,其工艺流程如下:
在过程Ⅰ涉及两个反应:
①
 ;
;②
 。下列说法错误的是
。下列说法错误的是A.在过程Ⅰ中, 起催化作用 起催化作用 |
B.在过程Ⅰ中生成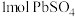 时,转移的电子数为 时,转移的电子数为 个 个 |
C.在过程Ⅰ中若改为加入 也能起到催化作用 也能起到催化作用 |
D.要证明过程Ⅰ中 起催化作用,加入 起催化作用,加入 溶液,溶液不变红色即可 溶液,溶液不变红色即可 |
您最近一年使用:0次
2022-01-20更新
|
150次组卷
|
4卷引用:江苏省响水中学2021-2022学年高二下学期开学测试化学试题
名校
解题方法
4 . 工业上由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备高纯碳酸锰。其主要工艺流程如下:

下列有关说法不正确 的是

下列有关说法
| A.可以通过搅拌的方式提高“酸浸”时粗锰粉的浸取率 |
B.向酸浸后的滤液中加入 ,反应的离子方程式为: ,反应的离子方程式为: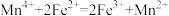 |
C.除铁时加入的物质X可以为 ,使 ,使 转化为 转化为 沉淀而除去 沉淀而除去 |
D.取除铁后的滤液,加入几滴KSCN溶液,无明显现象证明 已除尽 已除尽 |
您最近一年使用:0次
2022-01-23更新
|
217次组卷
|
3卷引用:江苏省盐城市2021-2022学年高二上学期期末考试化学试题
名校
5 . 下列说法不正确的是
| A.25 ℃时,0.1 mol·L-1 CH3COOH溶液的pH>1,证明CH3COOH是弱电解质 |
| B.BaSO4的水溶液不易导电,故BaSO4是弱电解质 |
| C.25 ℃时,0.1 mol·L-1的亚硫酸溶液比等浓度的亚硫酸钠溶液的导电能力弱 |
| D.醋酸、一水合氨、水都是弱电解质 |
您最近一年使用:0次
2021-04-21更新
|
225次组卷
|
3卷引用:江苏省淮安市高中校协作体2021-2022学年高二下学期期中考试化学试题
2019高一·浙江·专题练习
名校
解题方法
6 . 下列说法不正确的是
| A.定容时,因不慎使液面高于容量瓶的刻度线,必修重新配制 |
| B.根据燃烧产生的气味,可区分棉纤维和蛋白质纤维 |
| C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 |
D.取少量晶体放入试管中,再加入适量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若试纸变红,则可证明该晶体中含有 |
您最近一年使用:0次
2020-01-08更新
|
271次组卷
|
7卷引用:江苏省常州市第一中学2022-2023学年高一上学期期中质量调研化学试题
江苏省常州市第一中学2022-2023学年高一上学期期中质量调研化学试题江苏省天一中学2021-2022学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地067高中化学(已下线)【新东方】2020-47(已下线)【新东方】2020-51(已下线)【新东方】2020-40(已下线)【新东方】【2019】【高一上】【期中考】【FRZ】【化学】(浙江“七彩阳光”联盟)
名校
解题方法
7 . 亚氯酸钠(NaClO2)是一种杀菌漂白剂,可用于棉纺漂白,食品消毒,水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:

已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为___________ 。要证明产物中有 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,___________ 。
(2)向“ClO2发生器”中鼓入空气的作用是(填字母)___________ 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为___________ 。“吸收塔”中需要控制温度不超过20℃,其原因___________ 。
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液___________ 、___________ ,过滤,洗涤,干燥。


已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为
 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,(2)向“ClO2发生器”中鼓入空气的作用是(填字母)
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液

您最近一年使用:0次
8 . 回答下列问题:
(1)如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH(乙醇)、CO2、Fe2O3、FeCl3、KOH,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号。
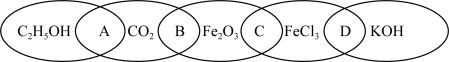
①相连的两种物质都是电解质的是_______ (填分类标准代号,下同),都是氧化物的是________ 。
②图中相连的两种物质能够相互反应的是_______ (填分类标准代号),所属的基本反应类型是________ 反应。写出这两种物质溶于水的电离方程式:_______ ,_______ 。
③用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质(FeCl3)的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为_______ ,要证明该分散系的实验方法是_______ 。
(2)分类方法应用广泛,属于同一类的物质具有相似性。
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可得出SO3与NaOH反应的化学方程式为_______ 。
②NaHCO3、NaHSO3、NaHS都属于非强酸形成的酸式盐,已知NaHCO3+HCl=NaCl+H2O+CO2↑、NaHCO3+NaOH=Na2CO3+H2O,完成NaHS与NaOH反应的化学方程式_______ 。
(1)如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH(乙醇)、CO2、Fe2O3、FeCl3、KOH,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号。

①相连的两种物质都是电解质的是
②图中相连的两种物质能够相互反应的是
③用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质(FeCl3)的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为
(2)分类方法应用广泛,属于同一类的物质具有相似性。
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可得出SO3与NaOH反应的化学方程式为
②NaHCO3、NaHSO3、NaHS都属于非强酸形成的酸式盐,已知NaHCO3+HCl=NaCl+H2O+CO2↑、NaHCO3+NaOH=Na2CO3+H2O,完成NaHS与NaOH反应的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 化学小组对Na在CO2气体中燃烧的产物进行了实验探究。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
【查阅资料】①N2的化学性质较稳定,通常情况下不与其他物质反应;
②PdCl2溶液能与CO反应生成黑色的金属钯;
③将酚酞溶液分别滴入BaCl2、NaCl、NaOH、Na2CO3四种溶液中的现象如下:
【实验1】化学小组在老师的指导下设计了如图所示装置(部分夹持仪器已略去):

步骤一:向甲装置的玻璃管中通入适量N2。
步骤二:停止通入N2,点燃酒精灯,再通入CO2气体,Na剧烈燃烧,生成黑色和白色两种固体;装置丁中有黑色沉淀产生;装置戊中溶液变浑浊。
(1)步骤一中通入N2的目的是___________ ;装置乙的作用是___________ 。
(2)根据步骤二的实验现象推理可知,Na与CO2反应的产物一定有___________ (填化学式)。
(3)写出装置丁中反应的化学方程式:___________ 。
【实验2】为了进一步探究步骤二中所得白色固体的组成,兴趣小组同学继续进行如下实验:取实验1步骤二中的白色固体于试管中,加入适量水后振荡,固体完全溶解,滴入几滴酚酞溶液,溶液由无色变为红色。
(4)有同学认为,根据实验2中溶液颜色的变化可以证明白色固体为Na2O,其推理的依据是___________ 。
(5)另有同学认为实验2中的现象并不能证明白色固体一定是Na2O,并设计了如下实验方案进行探究,请结合题给信息,完善验证该实验方案:取实验1步骤二中的白色固体于试管中,加适量水溶解,___________ ,证明该白色固体中必定含有Na2CO3,且不含Na2O。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
【查阅资料】①N2的化学性质较稳定,通常情况下不与其他物质反应;
②PdCl2溶液能与CO反应生成黑色的金属钯;
③将酚酞溶液分别滴入BaCl2、NaCl、NaOH、Na2CO3四种溶液中的现象如下:
| 溶液 | BaCl2 | NaCl | NaOH | Na2CO3 |
| 现象 | 无变化 | 无变化 | 溶液变为红色 | 溶液变为红色 |

步骤一:向甲装置的玻璃管中通入适量N2。
步骤二:停止通入N2,点燃酒精灯,再通入CO2气体,Na剧烈燃烧,生成黑色和白色两种固体;装置丁中有黑色沉淀产生;装置戊中溶液变浑浊。
(1)步骤一中通入N2的目的是
(2)根据步骤二的实验现象推理可知,Na与CO2反应的产物一定有
(3)写出装置丁中反应的化学方程式:
【实验2】为了进一步探究步骤二中所得白色固体的组成,兴趣小组同学继续进行如下实验:取实验1步骤二中的白色固体于试管中,加入适量水后振荡,固体完全溶解,滴入几滴酚酞溶液,溶液由无色变为红色。
(4)有同学认为,根据实验2中溶液颜色的变化可以证明白色固体为Na2O,其推理的依据是
(5)另有同学认为实验2中的现象并不能证明白色固体一定是Na2O,并设计了如下实验方案进行探究,请结合题给信息,完善验证该实验方案:取实验1步骤二中的白色固体于试管中,加适量水溶解,
您最近一年使用:0次
2023-04-30更新
|
401次组卷
|
3卷引用:江苏省连云港市东海县2022-2023学年高一上学期期中考试化学试题
名校
10 . 工业上以粗盐(含MgCl2、CaCl2杂质)为原料生产Na2CO3,工艺流程如图所示:

(1)滤渣A的主要成分是________ (写化学式)。若要回收滤渣A,需对滤渣A进行洗涤,证明已洗净的方法的是 ________ 。
(2)“碳酸化”时没有Na2CO3晶体析出,原因是________ 。
(3)向滤液B中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→ NaCl(aq)+NH4Cl(s)的过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为________ 、过滤、洗涤、干燥。

(4)“煅烧”发生的化学反应方程式为________ 。
(5)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28 g,则固体NaHCO3的质量为________ g(保留三位有效数字)。

(1)滤渣A的主要成分是
(2)“碳酸化”时没有Na2CO3晶体析出,原因是
(3)向滤液B中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→ NaCl(aq)+NH4Cl(s)的过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为

(4)“煅烧”发生的化学反应方程式为
(5)对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28 g,则固体NaHCO3的质量为
您最近一年使用:0次
2023-05-04更新
|
481次组卷
|
3卷引用:江苏省盐城一中、大丰中学等四校2022-2023学年高一上学期第二次学情调研化学试题



