解题方法
1 . 某待测溶液中可能含有 、
、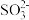 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
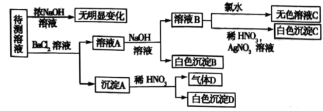
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
(2)待测溶液中是否有 、
、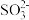 ?
?_______ 。
(3)形成沉淀B时反应的离子方程式为_______ 。
(4)形成沉淀C时反应的离子方程式为_______ 。
(5)若气体D遇空气变红棕色,则该反应的化学方程式为_______ 。
 、
、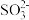 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 |
 、
、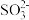 ?
?(3)形成沉淀B时反应的离子方程式为
(4)形成沉淀C时反应的离子方程式为
(5)若气体D遇空气变红棕色,则该反应的化学方程式为
您最近一年使用:0次
2021-02-16更新
|
684次组卷
|
2卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 章末综合检测卷
2 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②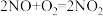 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;②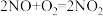 ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近一年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:广西河池市2020-2021学年高一上学期期末教学质量检测化学试题
解题方法
3 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
2021-01-27更新
|
457次组卷
|
3卷引用:江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题
江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练
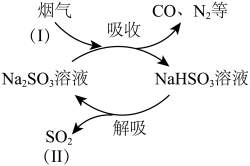
4 . 某工业烟气中含有CO、 、
、 等气体,用
等气体,用 溶液吸收并回收
溶液吸收并回收 的过程如图所示。
的过程如图所示。
(1) 的浓度:Ⅰ
的浓度:Ⅰ__________ Ⅱ(填“>”或“<”)。
(2)图示过程中可以循环利用的物质是___________________________________ (填化学式)。
(3)上述吸收过程中发生的主要反应的化学方程式是____________________________________ 。
(4)解吸过程需要加热,在这个过程中常伴有少量 产生。
产生。
①证明产物中含 的实验方法是:取少量解吸后的溶液,
的实验方法是:取少量解吸后的溶液,_______________________________ (填操作和现象)。
②产生 的原因是
的原因是_________________________________________________________________ 。
 、
、 等气体,用
等气体,用 溶液吸收并回收
溶液吸收并回收 的过程如图所示。
的过程如图所示。(1)
 的浓度:Ⅰ
的浓度:Ⅰ(2)图示过程中可以循环利用的物质是
(3)上述吸收过程中发生的主要反应的化学方程式是
(4)解吸过程需要加热,在这个过程中常伴有少量
 产生。
产生。①证明产物中含
 的实验方法是:取少量解吸后的溶液,
的实验方法是:取少量解吸后的溶液,②产生
 的原因是
的原因是
您最近一年使用:0次
2020-10-02更新
|
447次组卷
|
7卷引用:【区级联考】北京市朝阳区2018-2019学年高一上学期期末考试化学试题
【区级联考】北京市朝阳区2018-2019学年高一上学期期末考试化学试题新人教版必修2同步测试:5.1.3不同价态含硫物质的转化人教版(2019)必修第二册第五章第一节课时1山东省淄博市第七中学2019-2020学年高一3月线上考试化学试题必修第二册RJ第5章第一节 硫及其化合物 课时1 硫和二氧化硫高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 课时1 二氧化硫的性质和应用(已下线)第14讲 硫、二氧化硫【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)
解题方法
5 . 市场上一些看起来非常白而又鲜亮诱人的银耳竟然是用硫黄熏蒸而成的。央视记者暗访银耳变白内幕:工人们不停地对白色银耳进行翻炒,散发出一股刺鼻的气味;一名工人抓起淡黄色块状的东西放进一个小锅里,用火点燃,紧接着把小锅放进有薄膜覆盖的银耳地里。请回答下列问题:
(1)“工人抓起淡黄色块状的东西放进一个小锅里,用火点燃”。其中“淡黄色块状的东西”是__ (写化学式),其在空气中燃烧时火焰的颜色为__ 。该反应的化学方程式为__ 。
(2)用硫黄来熏蒸食品的主要目的是__ (填“增加营养”或“漂白”)。
(3)焦亚硫酸钠是一种食品添加剂,通常为白色或微黄色结晶粉末,其对应的酸是焦亚硫酸,焦亚硫酸可以看作两分子的H2SO3缩掉一分子水而形成的物质,所以焦亚硫酸的分子式为__ ,焦亚硫酸钠在工业上通常是通过将SO2通入饱和碳酸钠溶液中制得的,请写出该反应的化学方程式:__ ,该反应是__ (填“氧化还原反应”或“非氧化还原反应”)。焦亚硫酸钠在水溶液中反应可以生成SO ,所以溶液中存在SO
,所以溶液中存在SO ,由此可推断能够对食品进行漂白、杀菌的有效成分是
,由此可推断能够对食品进行漂白、杀菌的有效成分是__ ,该成分可以与有色物质结合,生成无色物质,该无色物质的特性是__ ,由此可见,食品中该物质超标时,容易导致食用者中毒。
(4)下列食品肯定不会用SO2熏制的是__ (填序号)。
A.色泽鲜艳的干黄花菜 B.苍白亮丽的馒头
C.鲜嫩无比的鲜菠菜 D.晶莹剔透的干鱼片
(5)小明的妈妈在农贸市场买了一些干燥的银耳,颜色为亮丽的白色。可是,一个月后拿出来准备食用时,发现银耳变为暗暗的淡黄色。请你判断该银耳是否用SO2熏蒸过,并说明理由:__ 。
(1)“工人抓起淡黄色块状的东西放进一个小锅里,用火点燃”。其中“淡黄色块状的东西”是
(2)用硫黄来熏蒸食品的主要目的是
(3)焦亚硫酸钠是一种食品添加剂,通常为白色或微黄色结晶粉末,其对应的酸是焦亚硫酸,焦亚硫酸可以看作两分子的H2SO3缩掉一分子水而形成的物质,所以焦亚硫酸的分子式为
 ,所以溶液中存在SO
,所以溶液中存在SO ,由此可推断能够对食品进行漂白、杀菌的有效成分是
,由此可推断能够对食品进行漂白、杀菌的有效成分是(4)下列食品肯定不会用SO2熏制的是
A.色泽鲜艳的干黄花菜 B.苍白亮丽的馒头
C.鲜嫩无比的鲜菠菜 D.晶莹剔透的干鱼片
(5)小明的妈妈在农贸市场买了一些干燥的银耳,颜色为亮丽的白色。可是,一个月后拿出来准备食用时,发现银耳变为暗暗的淡黄色。请你判断该银耳是否用SO2熏蒸过,并说明理由:
您最近一年使用:0次
2020-09-16更新
|
102次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
19-20高一·全国·课时练习
解题方法
6 . 下表是部分城市某日空气质量日报:
(1)由表可知,空气质量日报中涉及的污染物主要是________ 和可吸入颗粒物(PM10)。
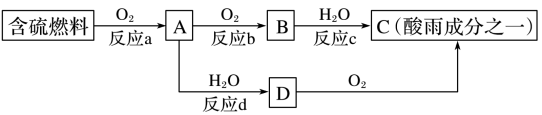
(2)SO2的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如图:
请回答下列问题:
①酸雨的pH________ (填“>”“<”或“=”)5.6。
②反应b的化学方程式为_________ 。
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是______ 。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:_________ 。
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
(2)SO2的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如图:

请回答下列问题:
①酸雨的pH
②反应b的化学方程式为
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。
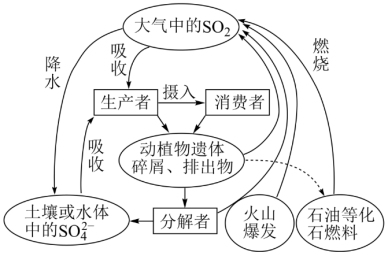
(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________ 。
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______ 。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________ ,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________ 。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______ (填化学式)。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是
| 选项 | 比较 | 氮循环 | 硫循环 |
| A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
| B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
| C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
| D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是
您最近一年使用:0次
名校
解题方法
8 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_____ (选填编号)。
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。
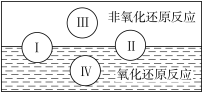
试写出有水参加且符合反应类型 IV 的一个化学方程式:___________________ 。
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
_____ NaIO3+ NaHSO3→ I2+ Na2SO4+ H2SO4+ H2O
②该反应还原剂是_____ ,_____ 元素被还原,若生成 1mol 氧化产物则转移电子数目为_____ NA。
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-_____ I-(填“>”或“<”),完成该反应_____________________________________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。

试写出有水参加且符合反应类型 IV 的一个化学方程式:
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
②该反应还原剂是
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-
您最近一年使用:0次
2017-12-22更新
|
282次组卷
|
2卷引用:上海交通大学附属中学2017-2018学年高一12月月考化学试题
9 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_____ (填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的热稳定性强于亚硫酸
C.同浓度的氢硫酸和亚硫酸的pH为前者大于后者
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________ 、___________ ,制得等量H2所需能量较少的是_______ 。
(3)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
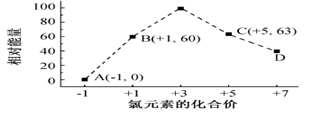
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的热稳定性强于亚硫酸
C.同浓度的氢硫酸和亚硫酸的pH为前者大于后者
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
(3)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是
②B→A+C反应的热化学方程式为
您最近一年使用:0次



