1 . 某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(ts)后,溶液突然变蓝。
查阅资料知:IO 在酸性溶液中氧化I-,发生的反应为IO
在酸性溶液中氧化I-,发生的反应为IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
(1)针对ts前溶液未变蓝,小组做出如下假设:
i.ts前未生成I2,是由于反应的活化能__ (填“大”或“小”),反应速率慢导致的。
ii.ts前生成了I2,但由于存在Na2SO3,Na2SO3将生成的I2还原。
(2)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入__ ,蓝色迅速消失,后再次变蓝。
(3)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。
实验III:K闭合后,电流表的指针偏转情况记录如表:
①K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,生成白色沉淀。
②0~t1s时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断a极的电极反应式为__ 。
③结合反应解释t2~t3s时指针回到“0”处的原因___ 。
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是__ (填字母代号)。
A.对比实验Ⅰ、Ⅱ,ts后溶液变蓝,I中SO 被完全氧化
被完全氧化
B.对比实验Ⅰ、Ⅲ,ts前IO 未发生反应
未发生反应
C.实验Ⅲ中指针返回X处的原因,可能是I2氧化SO
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(ts)后,溶液突然变蓝。
查阅资料知:IO
 在酸性溶液中氧化I-,发生的反应为IO
在酸性溶液中氧化I-,发生的反应为IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。(1)针对ts前溶液未变蓝,小组做出如下假设:
i.ts前未生成I2,是由于反应的活化能
ii.ts前生成了I2,但由于存在Na2SO3,Na2SO3将生成的I2还原。
(2)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入
(3)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。
实验III:K闭合后,电流表的指针偏转情况记录如表:
| 表盘 | 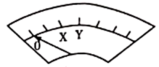 | 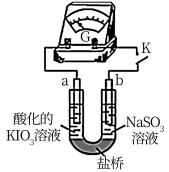 | ||
| 时间/s | 0~t1 | t2~t3 | t4 | |
| 偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
②0~t1s时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断a极的电极反应式为
③结合反应解释t2~t3s时指针回到“0”处的原因
(4)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是
A.对比实验Ⅰ、Ⅱ,ts后溶液变蓝,I中SO
 被完全氧化
被完全氧化B.对比实验Ⅰ、Ⅲ,ts前IO
 未发生反应
未发生反应C.实验Ⅲ中指针返回X处的原因,可能是I2氧化SO

您最近一年使用:0次
解题方法
2 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
(1)实验一:用如下装置(夹持,加热仪器略)制备 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
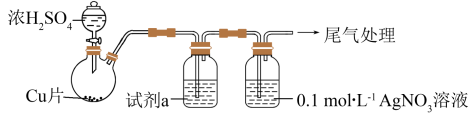
①浓 与Cu反应的化学方程式是
与Cu反应的化学方程式是_______ 。
②试剂a是_______ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为 、
、 或二者混合物。
或二者混合物。
(资料: 微溶于水;
微溶于水; 难溶于水,能溶于氨水生成
难溶于水,能溶于氨水生成 、
、 )
)
实验二:验证B的成分

加入盐酸后沉淀D大部分溶解,剩余少量沉淀F,推断D中主要是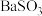 ,进而推断B中含有
,进而推断B中含有 。向滤液E中加入一种试剂,可进一步证实B中含有
。向滤液E中加入一种试剂,可进一步证实B中含有 。所用试剂及现象是
。所用试剂及现象是_________ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径。
的产生途径。
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有_____ ;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
溶液,未出现白色沉淀,可判断B中不含 。做出判断的理由:
。做出判断的理由:_______ 。
②实验三的结论:_____ 。
(4)实验一中 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是_____ 。
 与
与 溶液的反应。
溶液的反应。(1)实验一:用如下装置(夹持,加热仪器略)制备
 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
①浓
 与Cu反应的化学方程式是
与Cu反应的化学方程式是②试剂a是
(2)对体系中有关物质性质分析得出:沉淀B可能为
 、
、 或二者混合物。
或二者混合物。(资料:
 微溶于水;
微溶于水; 难溶于水,能溶于氨水生成
难溶于水,能溶于氨水生成 、
、 )
)实验二:验证B的成分

加入盐酸后沉淀D大部分溶解,剩余少量沉淀F,推断D中主要是
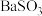 ,进而推断B中含有
,进而推断B中含有 。向滤液E中加入一种试剂,可进一步证实B中含有
。向滤液E中加入一种试剂,可进一步证实B中含有 。所用试剂及现象是
。所用试剂及现象是(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径。
的产生途径。①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有
 溶液,未出现白色沉淀,可判断B中不含
溶液,未出现白色沉淀,可判断B中不含 。做出判断的理由:
。做出判断的理由:②实验三的结论:
(4)实验一中
 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是
您最近一年使用:0次
3 . A、B、C、D是中学化学中常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示。
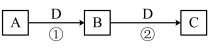
(1)若A是一种黄绿色气体,D是生产、生活中使用最广泛的金属单质。写出A的一种用途:_______________________ ,B转化为C的离子方程式为__________________________ 。
(2)若A是一种气态氢化物且水溶液呈碱性,D是一种气体单质,则C的化学式为______________ ,A转化为B的化学方程式为__________________________ 。
(3)若A是一元强碱且焰色反应为黄色,D是具有刺激性气味的酸性氧化物,则B的化学式为______________ ,A与C反应的离子方程式为__________________________ 。

(1)若A是一种黄绿色气体,D是生产、生活中使用最广泛的金属单质。写出A的一种用途:
(2)若A是一种气态氢化物且水溶液呈碱性,D是一种气体单质,则C的化学式为
(3)若A是一元强碱且焰色反应为黄色,D是具有刺激性气味的酸性氧化物,则B的化学式为
您最近一年使用:0次
名校
解题方法
4 . 从宏观现象探究微观本质是重要的化学学科素养。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
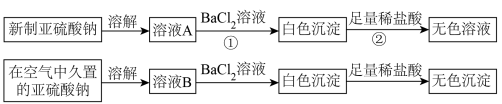
(1)写出上述实验中②的离子方程式:_________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有________ (填化学式)。
(3)亚硫酸钠晶体样品若变质,下列说法错误的是___________ 。
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
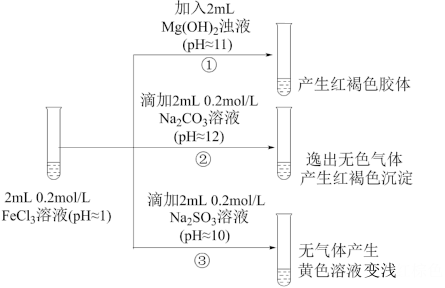
(1)①中反应的离子方程式是___________ 。
(2)②中逸出的无色气体是_____________ (写化学式)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是______________ 。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:

(1)写出上述实验中②的离子方程式:
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
(3)亚硫酸钠晶体样品若变质,下列说法错误的是
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
您最近一年使用:0次
20-21高一·全国·单元测试
解题方法
5 . 某待测溶液(阳离子为Na+)中可能含有 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、 、
、 、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
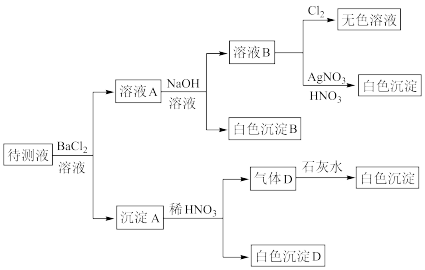
(1)待测液中是否含有 、
、 :
:_____________________ 。
(2)沉淀B的化学式为__________ ;生成沉淀B的离子方程式为___________________________ 。
(3)根据以上实验,待测液中肯定没有的离子是_____________________ ;肯定存在的离子还有_____________________ 。
 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、 、
、 、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
(1)待测液中是否含有
 、
、 :
:(2)沉淀B的化学式为
(3)根据以上实验,待测液中肯定没有的离子是
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
6 . 已知固体Na2SO3受热易分解。实验流程和结果如下:
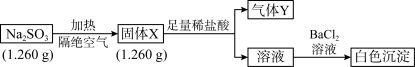
气体Y是一种纯净物,在标准状况下的密度为 1.18 g·L-1。请回答:
(1)白色沉淀的化学式:___ 。
(2)该流程中Na2SO3受热分解的化学方程式:______ 。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生。写出产生淡黄色沉淀的离子方程式:__________ (不考虑空气的影响)。

气体Y是一种纯净物,在标准状况下的密度为 1.18 g·L-1。请回答:
(1)白色沉淀的化学式:
(2)该流程中Na2SO3受热分解的化学方程式:
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生。写出产生淡黄色沉淀的离子方程式:
您最近一年使用:0次
7 . 某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
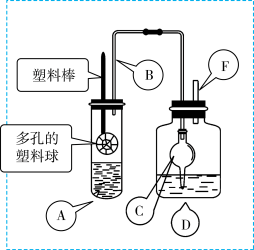
(1)请写出锌与硫酸反应产生SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________ 。
(3)长导管B的作用是______ ,如果没有这个设计,最终测定的临界浓度会_______ 。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______ 。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________ mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?______ (填“可行”或“不可行”),原因是_____ 。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)长导管B的作用是
(4)装置中干燥管C的作用是
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO
 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?
您最近一年使用:0次
2020-07-03更新
|
494次组卷
|
4卷引用:四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题
四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题(已下线)第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练吉林省长春外国语学校2021届高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
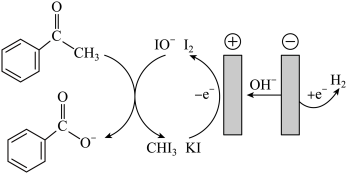
8 . 苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
实验步骤如下:
步骤I:电氧化合成
在电解池中加入适量 KI、20mL蒸馏水和20 mL的1,4-二氧六环,搅拌至完全溶解,再加入23.30 mL苯乙酮,连接电化学装置,恒定电流电解3h;
步骤II:清洗分离
反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去亲油性杂质,分离出水相和有机相;
步骤III:制得产品
用浓盐酸酸化水相至pH为1~2,接着加入饱和KHSO3溶液,振荡、抽滤、洗涤、干燥,称量得到产品12.2 g;
有关物质的数据如下表所示:
回答下列问题:
(1)步骤I中,阴极的电极反应式为___ ,阳极I-失去电子后的产物与OH-反应的离子方程式为_ 。
(2)步骤II蒸馏过程中,需要使用到的下图玻璃仪器有_______ (填字母),除下图外完成蒸馏操作还需的玻璃仪器______ (填仪器名称)。
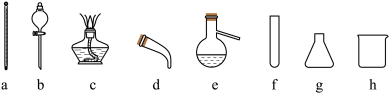
(3)步骤II分液过程中,应充分振荡,静置分层后________ (填字母)。
A.依次将有机相、水相从分液漏斗的上口倒出
B.依次将有机相、水相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是_________ 。
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为___________ 。
(6)本实验的产率是_________ 。

实验步骤如下:
步骤I:电氧化合成
在电解池中加入适量 KI、20mL蒸馏水和20 mL的1,4-二氧六环,搅拌至完全溶解,再加入23.30 mL苯乙酮,连接电化学装置,恒定电流电解3h;
步骤II:清洗分离
反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去亲油性杂质,分离出水相和有机相;
步骤III:制得产品
用浓盐酸酸化水相至pH为1~2,接着加入饱和KHSO3溶液,振荡、抽滤、洗涤、干燥,称量得到产品12.2 g;
有关物质的数据如下表所示:
| 物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
| 苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
| 苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
| 二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
(1)步骤I中,阴极的电极反应式为
(2)步骤II蒸馏过程中,需要使用到的下图玻璃仪器有
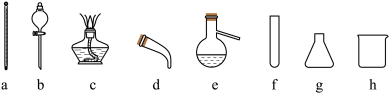
(3)步骤II分液过程中,应充分振荡,静置分层后
A.依次将有机相、水相从分液漏斗的上口倒出
B.依次将有机相、水相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为
(6)本实验的产率是
您最近一年使用:0次
解题方法
9 . 铜及其化合物向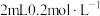
 溶液中滴加
溶液中滴加
 溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含
溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含 ,含有
,含有 、
、 和
和 。已知:Cu+
。已知:Cu+ Cu+Cu2+, Cu2+
Cu+Cu2+, Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
(1)用稀硫酸证实沉淀中含有 的实验现象是
的实验现象是___________ 。
(2)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因________ 。
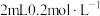
 溶液中滴加
溶液中滴加
 溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含
溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含 ,含有
,含有 、
、 和
和 。已知:Cu+
。已知:Cu+ Cu+Cu2+, Cu2+
Cu+Cu2+, Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。(1)用稀硫酸证实沉淀中含有
 的实验现象是
的实验现象是(2)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因
您最近一年使用:0次
2019高三·全国·专题练习
10 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为________ ,向反应后溶液中加_________ 溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如下:
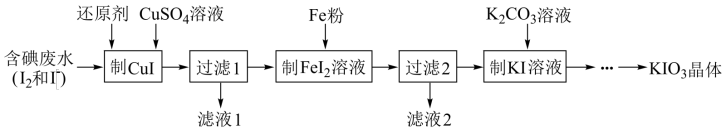
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______ 盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为________________ 。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO +5I-+6H+=3I2+3H2O 第二步反应的离子方程式为
+5I-+6H+=3I2+3H2O 第二步反应的离子方程式为________________ 。
(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg·kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL 6.000×10-4mol· L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O = 2I-+S4O
= 2I-+S4O 。计算该食盐试样中碘元素的含量
。计算该食盐试样中碘元素的含量________ mg·kg-1。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为
(2)一种由含碘废水制取碘酸钾的工艺如下:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加
②“制FeI2”时,发生反应的化学方程式为
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO
 +5I-+6H+=3I2+3H2O 第二步反应的离子方程式为
+5I-+6H+=3I2+3H2O 第二步反应的离子方程式为(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mg·kg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL 6.000×10-4mol· L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O
 = 2I-+S4O
= 2I-+S4O 。计算该食盐试样中碘元素的含量
。计算该食盐试样中碘元素的含量
您最近一年使用:0次



