2024高三下·全国·专题练习
解题方法
1 . 纯ClO2遇热易发生分解,工业上通常制成NaClO2固体以便运输和储存。制备NaClO2的实验装置如图所示(夹持装置省略),其中A装置制备ClO2,C装置用于制备NaClO2。回答下列问题:_______ 。
(2)装置A中发生反应的离子方程式为_______ 。向装置A中通入空气的目的是_______ 。
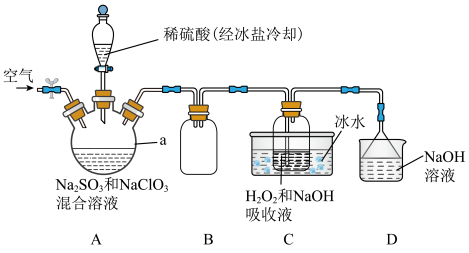
(2)装置A中发生反应的离子方程式为
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含 V2O5、K2O、SiO2少量Fe2O3制取YVO4的工艺流程如下:
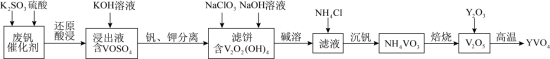
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是___________ 。V2O5被还原的离子方程式为___________ 。
(2)结合“碱溶”和“沉钒”可知,ClO 、VO
、VO 氧化性更强的是
氧化性更强的是___________ ,“沉钒”时发生反应的化学方程式为___________ 。
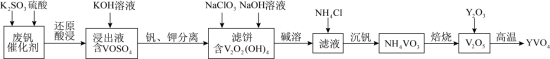
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是
(2)结合“碱溶”和“沉钒”可知,ClO
 、VO
、VO 氧化性更强的是
氧化性更强的是
您最近半年使用:0次
2023高三·全国·专题练习
3 .  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是___________ 。
(2)“焙烧”后固体产物有 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为___________ 。
(3)“酸化”步骤应选用的酸是___________ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?___________ ,其原因是___________ 。
(5)“沉淀”步骤中生成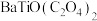 的化学方程式为
的化学方程式为___________ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是
(2)“焙烧”后固体产物有
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成
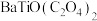 的化学方程式为
的化学方程式为
您最近半年使用:0次
解题方法
4 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
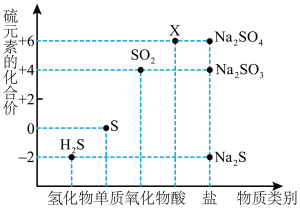
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目____________ 。
____Na2S+____Na2SO3+___H2SO4=____Na2SO4+____S↓+____H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设NA为阿伏加德罗常数的值。下列说法正确的是

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
____Na2S+____Na2SO3+___H2SO4=____Na2SO4+____S↓+____H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
(6)设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 mol铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4 L SO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6 g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 mol Na2O2与足量H2O反应,转移的电子数为NA |
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
5 . 完成下列实验设计题:
(1)证明CO2中含有CO___________
(2)证明SO2中含有CO2___________
(3)证明SO 中含有SO
中含有SO
___________
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸___________ (提供的试剂:0.1 mol·L-1 NaHCO3溶液、0.1 mol·L-1草酸溶液、0.1 mol·L-1 NaOH溶液、Na2C2O4晶体、甲基橙、酚酞、pH试纸)
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性___________ (提供的试剂:0.10 mol·L-1 NaNO2溶液、KMnO4溶液、0.10 mol·L-1 KI溶液、淀粉溶液、稀硝酸、稀硫酸)
(1)证明CO2中含有CO
(2)证明SO2中含有CO2
(3)证明SO
 中含有SO
中含有SO
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性
您最近半年使用:0次
6 . 某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为 ,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
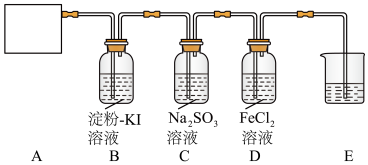
(1)该实验中A部分的装置是_______ (填字母)。
a.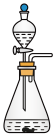 b.
b. 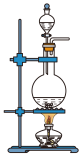 c.
c. 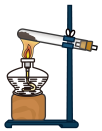 d.
d. 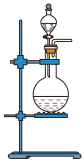
(2)装置B中的现象是_______ 。
(3)请写出装置D中发生反应的离子方程式:_______ ,装置E的作用是_______ 。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):_______ 。
(5)制取 的方法有多种,若A部分的装置是a,请再写出一种制备方法:
的方法有多种,若A部分的装置是a,请再写出一种制备方法:_______ (用化学方程式表示)。
 ,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是
a.
 b.
b.  c.
c.  d.
d. 
(2)装置B中的现象是
(3)请写出装置D中发生反应的离子方程式:
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):
(5)制取
 的方法有多种,若A部分的装置是a,请再写出一种制备方法:
的方法有多种,若A部分的装置是a,请再写出一种制备方法:
您最近半年使用:0次
解题方法
7 . 根据下列装置图回答问题:
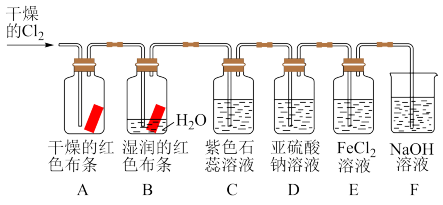
(1)装置A、B通入干燥的 后,观察到的现象是
后,观察到的现象是_______ ,根据现象可得出的结论是_______ 。
(2)装置B中发生反应的离子方程式是_______ 。
(3)实验开始后,观察装置C中的现象是_______ 。
(4)通入 时装置D中发生反应的离子方程式是
时装置D中发生反应的离子方程式是_______ 。
(5)装置E中发生反应的离子方程式是_______ 。
(6)装置F的作用是_______ 。

(1)装置A、B通入干燥的
 后,观察到的现象是
后,观察到的现象是(2)装置B中发生反应的离子方程式是
(3)实验开始后,观察装置C中的现象是
(4)通入
 时装置D中发生反应的离子方程式是
时装置D中发生反应的离子方程式是(5)装置E中发生反应的离子方程式是
(6)装置F的作用是
您最近半年使用:0次
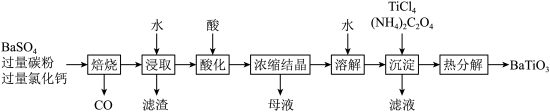
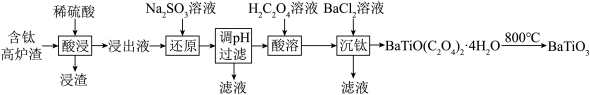
8 . 以含钛高炉渣(主要成分为 ,还含有少量
,还含有少量 为原料生产
为原料生产 的工艺流程如图所示。
的工艺流程如图所示。
相关阳离子浓度 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如表所示。
范围如表所示。
(1)“浸渣”的主要成分有 和
和_______ (填化学式)。
(2)“浸出液”中 以
以 形式存在,则“酸浸”时发生的主要反应的离子方程式为
形式存在,则“酸浸”时发生的主要反应的离子方程式为_______ 。
(3)向“浸出液”中加入 溶液的目的是
溶液的目的是_______ 。
(4)“调 ”的范围是
”的范围是_______ 。
(5)过滤得到的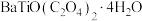 需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是
需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是_______ 。
(6)隔绝空气条件下,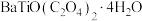 在800℃的温度下灼烧得到
在800℃的温度下灼烧得到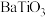 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
 ,还含有少量
,还含有少量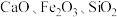 为原料生产
为原料生产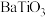 的工艺流程如图所示。
的工艺流程如图所示。
相关阳离子浓度
 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如表所示。
范围如表所示。| 阳离子 |  |  |  |
开始沉淀的 | 0.5 | 6.3 | 1.5 |
沉淀完全的 | 2.5 | 8.3 | 2.8 |
(1)“浸渣”的主要成分有
 和
和(2)“浸出液”中
 以
以 形式存在,则“酸浸”时发生的主要反应的离子方程式为
形式存在,则“酸浸”时发生的主要反应的离子方程式为(3)向“浸出液”中加入
 溶液的目的是
溶液的目的是(4)“调
 ”的范围是
”的范围是(5)过滤得到的
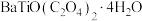 需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是
需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是(6)隔绝空气条件下,
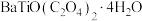 在800℃的温度下灼烧得到
在800℃的温度下灼烧得到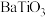 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
9 . 久置的 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。
资料:i. 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;
ii.BaS、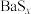 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;
iii.白色的 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。
将久置的 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
(1)推测 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是_______ 。
(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径二: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径三: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……
① 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是_______ 。
②请将途径三补充完全:白色沉淀由_______ 。
(3)为检验 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:
①取黄色溶液,向其中滴加 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是_______ 。
②改进实验,方案和现象如下:
实验一: 和
和 混合溶液
混合溶液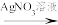 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)
实验二:
a.实验一的目的是_______ 。
b.试剂1是_______ ,试剂2是_______ 。
(4)检验 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?_______ 。说明理由:_______ 。
 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。资料:i.
 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;ii.BaS、
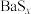 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;iii.白色的
 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。将久置的
 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。(1)推测
 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由
 与稀硫酸反应产生。
与稀硫酸反应产生。途径二:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。途径三:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……①
 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是②请将途径三补充完全:白色沉淀由
(3)为检验
 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:①取黄色溶液,向其中滴加
 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是②改进实验,方案和现象如下:
实验一:
 和
和 混合溶液
混合溶液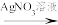 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)实验二:

a.实验一的目的是
b.试剂1是
(4)检验
 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
您最近半年使用:0次
10 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近半年使用:0次



