2023高三·全国·专题练习
1 .  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
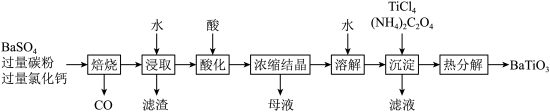
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是___________ 。
(2)“焙烧”后固体产物有 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的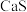 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为___________ 。
(3)“酸化”步骤应选用的酸是___________ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?___________ ,其原因是___________ 。
(5)“沉淀”步骤中生成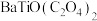 的化学方程式为
的化学方程式为___________ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是
(2)“焙烧”后固体产物有
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的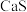 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成
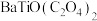 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
2 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
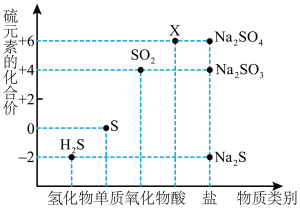
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目____________ 。
____Na2S+____Na2SO3+___H2SO4=____Na2SO4+____S↓+____H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设NA为阿伏加德罗常数的值。下列说法正确的是

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
____Na2S+____Na2SO3+___H2SO4=____Na2SO4+____S↓+____H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
(6)设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 mol铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4 L SO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6 g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 mol Na2O2与足量H2O反应,转移的电子数为NA |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 完成下列实验设计题:
(1)证明CO2中含有CO___________
(2)证明SO2中含有CO2___________
(3)证明SO 中含有SO
中含有SO
___________
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸___________ (提供的试剂:0.1 mol·L-1 NaHCO3溶液、0.1 mol·L-1草酸溶液、0.1 mol·L-1 NaOH溶液、Na2C2O4晶体、甲基橙、酚酞、pH试纸)
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性___________ (提供的试剂:0.10 mol·L-1 NaNO2溶液、KMnO4溶液、0.10 mol·L-1 KI溶液、淀粉溶液、稀硝酸、稀硫酸)
(1)证明CO2中含有CO
(2)证明SO2中含有CO2
(3)证明SO
 中含有SO
中含有SO
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性
您最近一年使用:0次
4 . 某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为 ,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
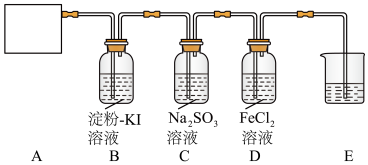
(1)该实验中A部分的装置是_______ (填字母)。
a. b.
b. 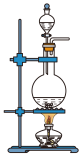 c.
c. 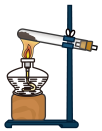 d.
d. 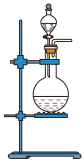
(2)装置B中的现象是_______ 。
(3)请写出装置D中发生反应的离子方程式:_______ ,装置E的作用是_______ 。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):_______ 。
(5)制取 的方法有多种,若A部分的装置是a,请再写出一种制备方法:
的方法有多种,若A部分的装置是a,请再写出一种制备方法:_______ (用化学方程式表示)。
 ,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是
a.
 b.
b.  c.
c.  d.
d. 
(2)装置B中的现象是
(3)请写出装置D中发生反应的离子方程式:
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):
(5)制取
 的方法有多种,若A部分的装置是a,请再写出一种制备方法:
的方法有多种,若A部分的装置是a,请再写出一种制备方法:
您最近一年使用:0次
解题方法
5 . 根据下列装置图回答问题:
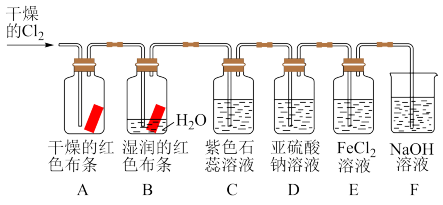
(1)装置A、B通入干燥的 后,观察到的现象是
后,观察到的现象是_______ ,根据现象可得出的结论是_______ 。
(2)装置B中发生反应的离子方程式是_______ 。
(3)实验开始后,观察装置C中的现象是_______ 。
(4)通入 时装置D中发生反应的离子方程式是
时装置D中发生反应的离子方程式是_______ 。
(5)装置E中发生反应的离子方程式是_______ 。
(6)装置F的作用是_______ 。

(1)装置A、B通入干燥的
 后,观察到的现象是
后,观察到的现象是(2)装置B中发生反应的离子方程式是
(3)实验开始后,观察装置C中的现象是
(4)通入
 时装置D中发生反应的离子方程式是
时装置D中发生反应的离子方程式是(5)装置E中发生反应的离子方程式是
(6)装置F的作用是
您最近一年使用:0次
6 . 以含钛高炉渣(主要成分为 ,还含有少量
,还含有少量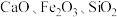 为原料生产
为原料生产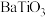 的工艺流程如图所示。
的工艺流程如图所示。
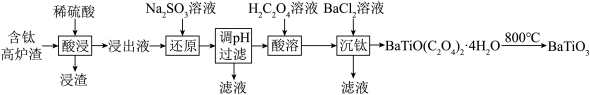
相关阳离子浓度 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如表所示。
范围如表所示。
(1)“浸渣”的主要成分有 和
和_______ (填化学式)。
(2)“浸出液”中 以
以 形式存在,则“酸浸”时发生的主要反应的离子方程式为
形式存在,则“酸浸”时发生的主要反应的离子方程式为_______ 。
(3)向“浸出液”中加入 溶液的目的是
溶液的目的是_______ 。
(4)“调 ”的范围是
”的范围是_______ 。
(5)过滤得到的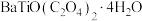 需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是
需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是_______ 。
(6)隔绝空气条件下,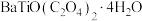 在800℃的温度下灼烧得到
在800℃的温度下灼烧得到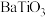 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
 ,还含有少量
,还含有少量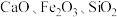 为原料生产
为原料生产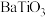 的工艺流程如图所示。
的工艺流程如图所示。
相关阳离子浓度
 时,形成氢氧化物沉淀的
时,形成氢氧化物沉淀的 范围如表所示。
范围如表所示。| 阳离子 |  |  |  |
开始沉淀的 | 0.5 | 6.3 | 1.5 |
沉淀完全的 | 2.5 | 8.3 | 2.8 |
(1)“浸渣”的主要成分有
 和
和(2)“浸出液”中
 以
以 形式存在,则“酸浸”时发生的主要反应的离子方程式为
形式存在,则“酸浸”时发生的主要反应的离子方程式为(3)向“浸出液”中加入
 溶液的目的是
溶液的目的是(4)“调
 ”的范围是
”的范围是(5)过滤得到的
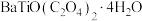 需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是
需要经过洗涤,减压烘干,检验沉淀是否洗净的方法是(6)隔绝空气条件下,
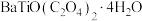 在800℃的温度下灼烧得到
在800℃的温度下灼烧得到 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
21-22高一下·广东广州·期中
7 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近一年使用:0次
8 . 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2,还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
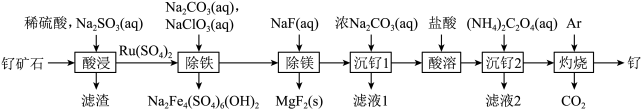
(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为____ 。
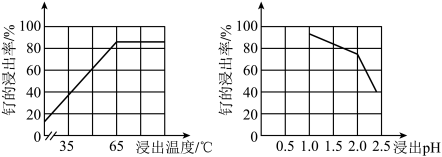
(2)“酸浸”时,Na2SO3的作用____ 。“滤渣”的主要成分有SiO2和____ (填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是____ 。
(3)“除铁”的离子方程式为____ 。(提示:1molNaClO3参与反应,转移6mol电子)
(4)从“滤液2”中可提取一种化肥,其电子式为____ 。
(5)“灼烧”时Ar的作用是____ 。
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为____ 。(保留三位有效数字)

(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为
(2)“酸浸”时,Na2SO3的作用

(3)“除铁”的离子方程式为
(4)从“滤液2”中可提取一种化肥,其电子式为
(5)“灼烧”时Ar的作用是
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为
您最近一年使用:0次
2022-05-10更新
|
1863次组卷
|
15卷引用:专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考前特训 [综合大题分类规范练](已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)河南省新乡市2022届高三第三次模拟理科综合化学试题河北省保定市2022届高三第二次模拟考试化学试题河南省名校联盟2022届高三下学期5月大联考理科综合化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编广东省广州市海珠外国语实验中学2022-2023学年高三上学期第二次阶段性考试化学试题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题
9 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
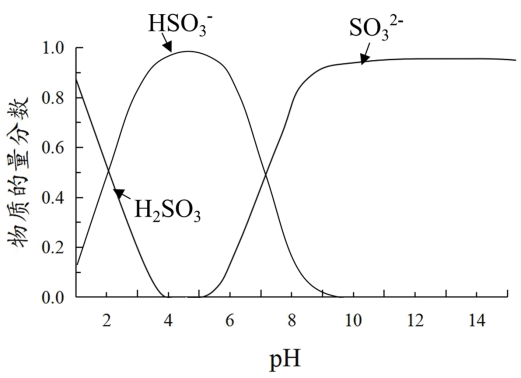
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1783次组卷
|
6卷引用:天天练6-10
天天练6-10北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
20-21高三·广东广州·阶段练习
名校
10 . 某研究小组同学为探究锌与硫酸反应生成 SO2、H2的临界浓度(浓硫酸能与锌反应生成 SO2的最低浓度)设计了如图实验 (加热和夹持装置已省略)。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
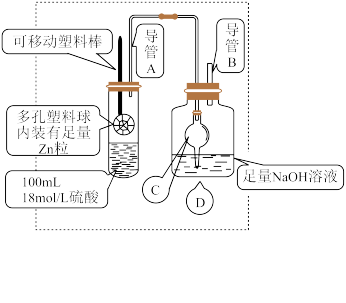
(1)请写出锌与硫酸反应产生 SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是_______ 。
(3)装置中干燥管C的作用是_______ 。
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是_______ 。
②浓硫酸与锌反应的临界浓度为:_______ mol/L。(用含a的计算式表示,忽略溶液体积变化)
(5)导管A竖直部分较长,其作用是_______ 。
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是_______ 。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生 SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)装置中干燥管C的作用是
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是
②浓硫酸与锌反应的临界浓度为:
(5)导管A竖直部分较长,其作用是
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO
 ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
您最近一年使用:0次



