2024高三·上海·专题练习
1 . PtF6是极强的氧化剂,Xe和PtF6可制稀有气体离子化合物。
六氟合铂酸氙([XeF]+[Pt2F11]-)的制备方式如图所示:
2.上述过程中属于氧化还原反应的是_______。
3.氟气通入氙(Xe)会产生XeF2、XeF4、XeF6三种氟化物气体。现将1 mol的Xe和9 mol的F2同时通入50 L的容器中,反应10 min后,测得容器内共有8.9 mol气体,且三种氟化物的比例为XeF2∶XeF4∶XeF6 = 1∶6∶3,则10 min内XeF4的速率v(XeF4) = _______ 。
六氟合铂酸氙([XeF]+[Pt2F11]-)的制备方式如图所示:
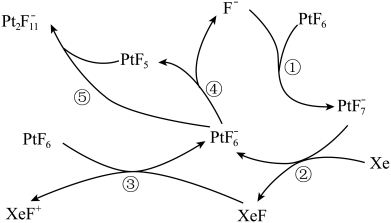
| A.PtF6 | B.PtF | C.F- | D.XeF+ |
| A.② | B.③ | C.④ | D.⑤ |
您最近一年使用:0次
真题
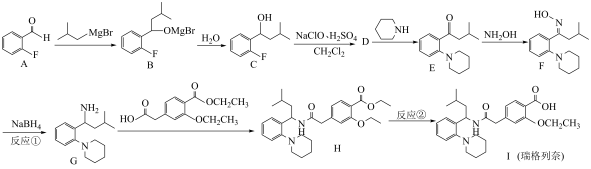
2 . 瑞格列奈的制备。_______ 。
(2)反应①的反应类型为_______。
(3)反应②的试剂和条件是_______ 。
(4)D的分子式是 ,画出D的结构简式
,画出D的结构简式_______ 。
(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式_______ 。
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为 。
。
(6)G对映异构体分离后才能发生下一步反应
①G中有_______ 个手性碳 D.
D. 
(7)用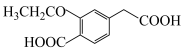 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因_______ 。
(8)以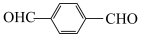 和
和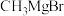 合成
合成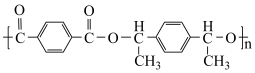
_______ 。
(2)反应①的反应类型为_______。
| A.还原反应 | B.消去反应 | C.取代反应 | D.氧化反应 |
(3)反应②的试剂和条件是
(4)D的分子式是
 ,画出D的结构简式
,画出D的结构简式(5)化合物D有多种同分异构体,写出满足下列条件的D的同分异构体的结构简式
i.芳香族化合物,可以发生银镜反应;
ii.核磁共振氢谱中显示出3组峰,其峰面积之比为
 。
。(6)G对映异构体分离后才能发生下一步反应
①G中有
②已知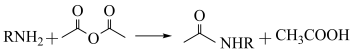 ,用
,用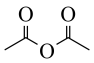 和谷氨酸可制备
和谷氨酸可制备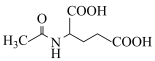 ,该物质可用于分离对映异构体。谷氨酸的结构简式为:
,该物质可用于分离对映异构体。谷氨酸的结构简式为:
 D.
D. 
(7)用
 与G可直接制取H。但产率变低,请分析原因
与G可直接制取H。但产率变低,请分析原因(8)以
 和
和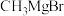 合成
合成
您最近一年使用:0次
真题
3 . 下列关于氟元素的性质说法正确的是
| A.原子半径最小 | B.原子第一电离能最大 |
| C.元素的电负性最强 | D.最高正化合价为+7 |
您最近一年使用:0次
4 . 萤石( )与浓硫酸共热可制备HF气体,写出该反应的化学方程式:
)与浓硫酸共热可制备HF气体,写出该反应的化学方程式:_______ ,该反应中体现浓硫酸的性质是_______ 。
A.强氧化性 B.难挥发性 C.吸水性 D.脱水性
 )与浓硫酸共热可制备HF气体,写出该反应的化学方程式:
)与浓硫酸共热可制备HF气体,写出该反应的化学方程式:A.强氧化性 B.难挥发性 C.吸水性 D.脱水性
您最近一年使用:0次
5 . 下列应用与盐类水解无关的是
| A.泡沫灭火器 | B.草木灰不宜与铵态氮肥混合使用 |
| C.纯碱去油污 | D.漂粉精杀菌消毒 |
您最近一年使用:0次
名校
6 . Ⅰ.提取碘。高分子树脂吸附法是工业提取碘的方法之一,其流程如图: 只能将
只能将 氧化为
氧化为 ,同时生成NO气体;
,同时生成NO气体;
(1)步骤④“洗脱”反应的离子方程式为___________ 。
(2)经步骤①和④所得溶液中的 :①
:①___________ ④。(选填“>”、“<”“=”)
(3)步骤⑤“氧化”的离子方程式为___________ 。
(4)步骤⑤“氧化”没有选择氯气,而是选择了价格较高的 ,原因是
,原因是___________ 。
(5)高分子树脂上吸附的 还能用浓
还能用浓 溶液洗脱,该反应的离子方程式是
溶液洗脱,该反应的离子方程式是___________ 。
Ⅱ.利用海水可以缓解煤燃烧过程中排放的 造成的环境问题,其工艺流程如图所示:
造成的环境问题,其工艺流程如图所示: 、
、 等分子或离子,需要用氧气进行“氧化”处理,写出
等分子或离子,需要用氧气进行“氧化”处理,写出 参加反应的离子方程式:
参加反应的离子方程式:___________ 。
(7)“氧化”后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是___________ 。
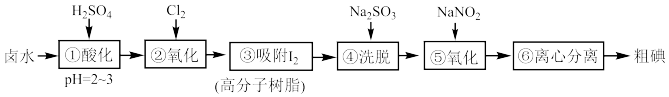
 只能将
只能将 氧化为
氧化为 ,同时生成NO气体;
,同时生成NO气体;(1)步骤④“洗脱”反应的离子方程式为
(2)经步骤①和④所得溶液中的
 :①
:①(3)步骤⑤“氧化”的离子方程式为
(4)步骤⑤“氧化”没有选择氯气,而是选择了价格较高的
 ,原因是
,原因是(5)高分子树脂上吸附的
 还能用浓
还能用浓 溶液洗脱,该反应的离子方程式是
溶液洗脱,该反应的离子方程式是Ⅱ.利用海水可以缓解煤燃烧过程中排放的
 造成的环境问题,其工艺流程如图所示:
造成的环境问题,其工艺流程如图所示: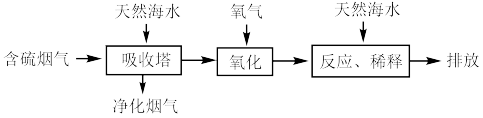
 、
、 等分子或离子,需要用氧气进行“氧化”处理,写出
等分子或离子,需要用氧气进行“氧化”处理,写出 参加反应的离子方程式:
参加反应的离子方程式:(7)“氧化”后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是
您最近一年使用:0次
名校
7 . 下面描述了 的一些化学性质,其中
的一些化学性质,其中 作氧化剂的是
作氧化剂的是
 的一些化学性质,其中
的一些化学性质,其中 作氧化剂的是
作氧化剂的是A.溶于水形成不稳定的 |
B.在一定条件下与 反应生成 反应生成 |
C.通入到 溶液中,溶液的棕黄色褪去 溶液中,溶液的棕黄色褪去 |
D.与 气体混合出现淡黄色固体 气体混合出现淡黄色固体 |
您最近一年使用:0次
名校
解题方法
8 . 下列物质中不含有硫元素的是
| A.重晶石 | B.蛋白质 | C.尿素 | D.明矾 |
您最近一年使用:0次
9 . 工业上可以用 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下:
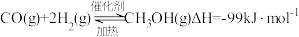
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
2.某温度下,将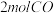 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得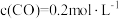 ,则
,则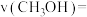
_____ 。
3.将 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
4.反应中的 ,可由如下反应制得:
,可由如下反应制得: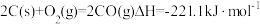 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:_____ 。
5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:_____ 极。
(2)写出a极反应式_____ 。
6. ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示:
(1)写出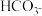 的电离平衡常数表达式
的电离平衡常数表达式
_____ 。
(2)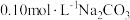 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_____ 。
(3)向 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是_____ 。
7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:_____ 。
 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下: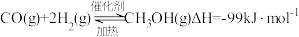
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
| A.缩短达到平衡所需时间 | B.增大甲醇的体积分数 |
| C.提高单位时间内甲醇的产量 | D.提高 的平衡转化率 的平衡转化率 |
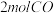 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得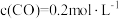 ,则
,则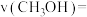
3.将
 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
A.温度: | B.正反应速率: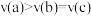 |
C.平衡常数: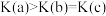 | D.平均摩尔质量: |
 ,可由如下反应制得:
,可由如下反应制得: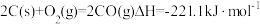 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:
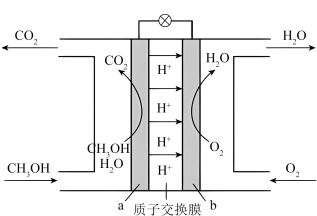
(2)写出a极反应式
6.
 ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示: |  | |
 | 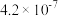 | 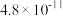 |
 |  |  |
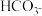 的电离平衡常数表达式
的电离平衡常数表达式
(2)
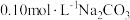 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(3)向
 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:
您最近一年使用:0次
解题方法
10 . 氯碱工业的生产原理是_____ (写化学方程式)。检验阳极产物的方法是_____ 。
您最近一年使用:0次



