名校
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取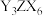 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: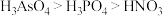
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取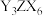 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
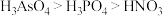
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
2022-07-29更新
|
1152次组卷
|
3卷引用:浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题
浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
20-21高一·浙江·阶段练习
解题方法
2 . 化合物A中含有三种元素,3.68gA 在氧气中充分煅烧后生成1.28 gB、1.60 gC和气体D,物质A~H存在如下转化关系。
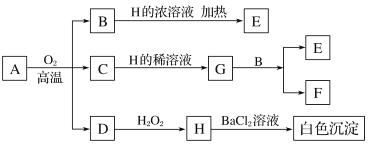
已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A的化学式:___________ ,其中非金属元素在元素周期表中的位置为:___________ 。
(2)检验气体D的实验方法:___________ 。
(3)写出B与H的浓溶液反应的化学方程式:___________ 。
(4)写出A在氧气中充分煅烧的化学方程式:___________ 。

已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A的化学式:
(2)检验气体D的实验方法:
(3)写出B与H的浓溶液反应的化学方程式:
(4)写出A在氧气中充分煅烧的化学方程式:
您最近一年使用:0次
3 . 某化合物X由三种元素组成,其转化关系如下图所示:
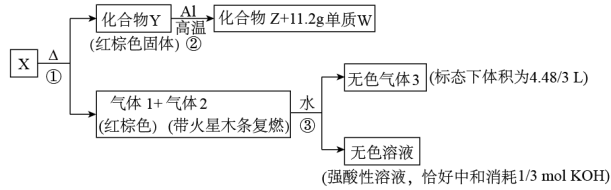
已知:无色气体3在空气中转变为红棕色气体1。
回答以下问题:
(1) 在元素周期表中的位置
在元素周期表中的位置___________ ;
(2)步骤②的化学反应方程式是___________ ;
(3)气体1与水发生反应的离子反应方程式___________ ;
(4)鉴别红棕色气体1与 蒸气的下列方法中,合理的是
蒸气的下列方法中,合理的是___________
A.通入水中观察溶液的颜色变化
B.直接观察两种气体的颜色
C.分别通入 溶液中观察有否沉淀
溶液中观察有否沉淀
D.用湿润的 淀粉试纸检验是否变蓝色
淀粉试纸检验是否变蓝色
(5)化合物X的化学式为___________

已知:无色气体3在空气中转变为红棕色气体1。
回答以下问题:
(1)
 在元素周期表中的位置
在元素周期表中的位置(2)步骤②的化学反应方程式是
(3)气体1与水发生反应的离子反应方程式
(4)鉴别红棕色气体1与
 蒸气的下列方法中,合理的是
蒸气的下列方法中,合理的是A.通入水中观察溶液的颜色变化
B.直接观察两种气体的颜色
C.分别通入
 溶液中观察有否沉淀
溶液中观察有否沉淀D.用湿润的
 淀粉试纸检验是否变蓝色
淀粉试纸检验是否变蓝色(5)化合物X的化学式为
您最近一年使用:0次
20-21高一下·浙江·阶段练习
4 . A、B、C是中学化学中常见的物质,且A、B、C均含有同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。请回答:
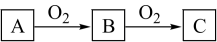
(1)若B是无色气体,C是红棕色气体。
①A、B、C所含相同元素在元素周期表中的位置是___________ 。
②下列说法正确的是___________ (填字母)。
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式___________ 。
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
①下列说法不正确的是___________ (填字母) 。
a. A一定是黄色晶体
b. 可以用上述转化关系制备硫酸
c. B与水反应做还原剂。
②C的水溶液与氢氧化钠的反应为___________ (填吸热或放热)反应。
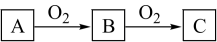
(1)若B是无色气体,C是红棕色气体。
①A、B、C所含相同元素在元素周期表中的位置是
②下列说法正确的是
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
①下列说法不正确的是
a. A一定是黄色晶体
b. 可以用上述转化关系制备硫酸
c. B与水反应做还原剂。
②C的水溶液与氢氧化钠的反应为
您最近一年使用:0次
5 . 化合物A中含有三种元素,3.68gA在氧气中充分煅烧后生成1.28gB、1.60gC和气体D,物质A~H存在如图转化关系。
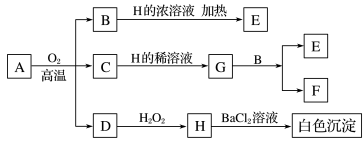
已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A中非金属元素在元素周期表中的位置为:___ ;
(2)检验气体D的实验方法:___ ;
(3)写出B与H的浓溶液反应的化学方程式:___ ;
(4)写出A在氧气中充分煅烧的化学方程式:___ 。

已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A中非金属元素在元素周期表中的位置为:
(2)检验气体D的实验方法:
(3)写出B与H的浓溶液反应的化学方程式:
(4)写出A在氧气中充分煅烧的化学方程式:
您最近一年使用:0次
6 . 氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________ 。
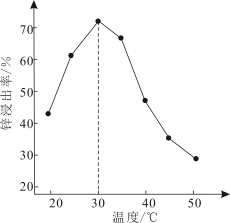
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________ 。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________ 。
(4)“滤渣3”除锌外,主要成分为___________________ 。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________ (写名称)。电解后的电解液经补充_________ (写一种物质的化学式)后可返回至__________________ (填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________ 。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式
(4)“滤渣3”除锌外,主要成分为
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为
您最近一年使用:0次
7 . X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):

(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____

(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:
②如何设计实验检验Z中阳离子:
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:
②写出Z与Cu反应的化学方程式
您最近一年使用:0次
8 . 甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为______ (任写一个)。
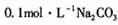 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为______ 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为_________ ;利用该反应设计的燃料电池中,通入甲的电极为电池的_____ (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为_______ ;
②甲与水相比,热稳定性较强的是________ (填化学式)。
(1)若丙为Na2C03,反应的化学方程式为
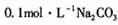 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是
您最近一年使用:0次
2016-12-09更新
|
304次组卷
|
3卷引用:2014-2015学年浙江省杭州市五校联盟高二统测模拟考化学试卷
9 . Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______ ;
②A与H2O反应的离子反应方程式为__________ .
③X可能为______ (填代号).
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为_________ .
②A与H2O反应的化学反应方程式为___________ .
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图_________ 。
(2)化合物A的化学式为________ ;
请设计实验方案验证A中阴离子_______ ;
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式_________ .
(4)请写出气体C与氯气发生氧化还原反应的化学方程式_________ .

(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为
②A与H2O反应的化学反应方程式为
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图
(2)化合物A的化学式为
请设计实验方案验证A中阴离子
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式
(4)请写出气体C与氯气发生氧化还原反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 下表列出了①~⑪11种元素在元素周期表中的位置:
(1)写出元素③形成单质的电子式___________ ②的最高价氧化物的结构式为___________ ;⑩的最高价氧化物的水化物的化学式为___________ 。
(2)画这11种元素中,非金属性最强的元素的原子结构示意图___________ 。
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式___________ 。
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因___________ 。
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为___________ 。
②下列推断正确的是___________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑪ |
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)写出⑧的氧化物与⑥的最高价氧化物的水化物反应的离子方程式
(4)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为
②下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,写出Y的原子序数b与a可能存在的所有的关系
您最近一年使用:0次
2024-01-21更新
|
79次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷



