名校
解题方法
1 . 电石(主要成分为 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
(1)碳元素在元素周期表中的位置为_______ ; 的电子式为
的电子式为_______ 。
(2)①目前工业上合成电石主要采用氧热法。
已知: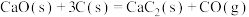
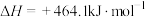 ;
;

 。
。
若不考虑热量耗散,物料转化率均为 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产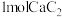 ,投料的量为
,投料的量为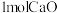 、
、_______ 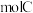 及
及_______ 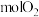 。
。
②制乙炔后的固体废渣主要成分为 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为_______ 。
(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:
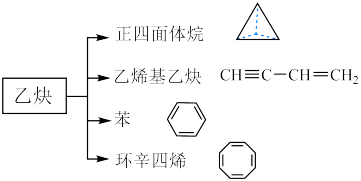
下列说法正确的是_______(填标号)。
(4)以乙炔为原料可制备维尼纶(PVAC),其合成路线如下:
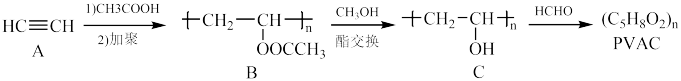
① 中官能团名称为
中官能团名称为_______ 。
② 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为_______ 。
③ 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为_______ 。
 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:(1)碳元素在元素周期表中的位置为
 的电子式为
的电子式为(2)①目前工业上合成电石主要采用氧热法。
已知:
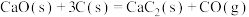
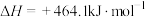 ;
;
 。
。若不考虑热量耗散,物料转化率均为
 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产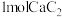 ,投料的量为
,投料的量为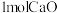 、
、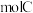 及
及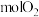 。
。②制乙炔后的固体废渣主要成分为
 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:

下列说法正确的是_______(填标号)。
| A.乙烯基乙炔分子中所有原子可以处于同一直线上 |
B.常温下, 苯中含碳碳双键数目约为 苯中含碳碳双键数目约为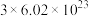 |
| C.环辛四烯与苯均能使酸性高锰酸钾溶液褪色 |
| D.正四面体烷与环辛四烯的一取代物均只有一种 |
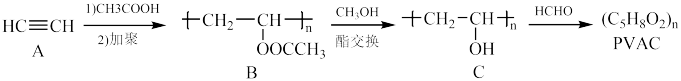
①
 中官能团名称为
中官能团名称为②
 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为③
 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为
您最近一年使用:0次
解题方法
2 . 已知A-O分别代表一种物质,它们之间的转化关系如图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气D是一种离子化合物,其阴阳离子的个数比为2∶3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与C的水溶液反应生成蓝色沉淀。
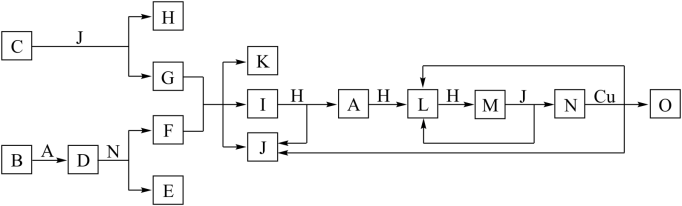
请回答下列问题:
(1)组成H单质的元素在元素周期表中的位置是____ 。化合物C的电子式为_____ 。
(2)写出I与H在点燃条件下反应生成A和J的化学方程式:_____ 。
(3)写出D与N生成E和F的化学方程式:_____ 。
(4)N与Cu反应生成L的反应中,氧化剂与还原剂的物质的量之比为:_____ 。
(5)图中,在同一反应里一种物质既作氧化剂,又作还原剂的反应共有_____ 个。
(6)实验室制备I的化学方程式为:_____ 。

请回答下列问题:
(1)组成H单质的元素在元素周期表中的位置是
(2)写出I与H在点燃条件下反应生成A和J的化学方程式:
(3)写出D与N生成E和F的化学方程式:
(4)N与Cu反应生成L的反应中,氧化剂与还原剂的物质的量之比为:
(5)图中,在同一反应里一种物质既作氧化剂,又作还原剂的反应共有
(6)实验室制备I的化学方程式为:
您最近一年使用:0次
解题方法
3 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
SbCl3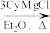 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)

(1)已知Sb的原子序数为51,则它在元素周期表中的位置是_______ ,属于_____ (填s”、“p”、“d”或“ds”)区元素。
(2)CuI中Cu+的价电子排布图为_______ ;SbCy3只能与一个Cu+配位的原因是_____
(3)比较F和I的第一电离能大小,并说明理由:_______
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是_______ 晶体,预测SbCl3的VSEPR模型名称为_______
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______ ,_______
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式_______ ,设阿伏加德罗常数的值为NA,已知SbCy3的相对分子质量是371,则该铜碘杂化团簇的密度_______ g/cm3(列计算式)
SbCl3
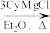 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)
(1)已知Sb的原子序数为51,则它在元素周期表中的位置是
(2)CuI中Cu+的价电子排布图为
(3)比较F和I的第一电离能大小,并说明理由:
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及
 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式
您最近一年使用:0次
解题方法
4 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如下:
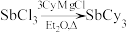 (
(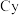 代表
代表 )
)

(1)已知 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是______ ,属于______ (填“s”、“p”、“d”或“ ”)区元素。
”)区元素。
(2) 中
中 的价电子排布图为
的价电子排布图为______ ;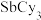 只能与一个
只能与一个 配位的原因是
配位的原因是_______ 。
(3)比较F和I的第一电离能大小,并说明理由:_______ 。
(4)已知 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是_____ 晶体,预测 的
的 模型名称为
模型名称为______ 。
(5) (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及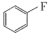 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_____ 、_____ 。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为 ,棱间夹角为
,棱间夹角为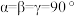 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为_______ ;设阿伏加德罗常数的值为 ,已知
,已知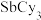 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是_______  (列计算式)。
(列计算式)。
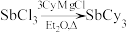 (
(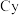 代表
代表 )
)
(1)已知
 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是 ”)区元素。
”)区元素。(2)
 中
中 的价电子排布图为
的价电子排布图为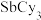 只能与一个
只能与一个 配位的原因是
配位的原因是(3)比较F和I的第一电离能大小,并说明理由:
(4)已知
 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是 的
的 模型名称为
模型名称为(5)
 (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为
 ,棱间夹角为
,棱间夹角为 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为 ,已知
,已知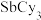 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是 (列计算式)。
(列计算式)。
您最近一年使用:0次
2021-02-01更新
|
274次组卷
|
3卷引用:山西省太原市2021届高三上学期期末考试化学试题
5 . X、Y、Z、W四种化合物均由元素周期表前18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
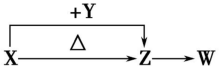
请回答:
(1)W的化学式是__________ 。
(2)X与Y在溶液中反应的离子方程式是__________ 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中生成白色沉淀,装置V中可收集到一种无色气体。
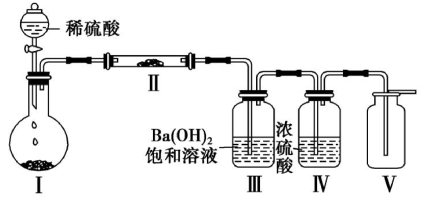
①装置I中反应的化学方程式是__________ 。装置II中物质的化学式是__________ 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的位置V中气体,该化合物的化学式是__________ ,所需仪器装置是______ (从上图选择必要装置,填写编号)。

请回答:
(1)W的化学式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中生成白色沉淀,装置V中可收集到一种无色气体。

①装置I中反应的化学方程式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的位置V中气体,该化合物的化学式是
您最近一年使用:0次
2011·山西太原·三模
解题方法
6 . 已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离子的方法,反应②是工业、生产N的重要反应。请回答下列问题:
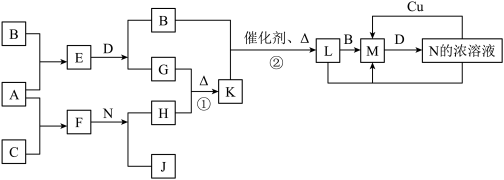
(1)B元素在元素周期表中的位置是__________ ,F的电子式是_____________ 。
(2)写出反应①的离子方程式:___________ ;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________ (请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________ 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____ v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________ (填“增大”、“不变”或“减小”),B的转化率_________ 。(填“升高”、“不变”或“降低”),L的体积分数___________ (填“增大”、“不变”、“减小”或“无法确定”)。

(1)B元素在元素周期表中的位置是
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
您最近一年使用:0次
7 . 硅在无机非金属材料中扮演着主要角色。回答下列问题:
(1)写出硅在元素周期表中的位置_______ ;硅有非常重要的用途,请写出其中一种:_______ 。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡( ,铜为+2价),则x=
,铜为+2价),则x=_______ 。
(3)工业上提纯硅有多种路线,其中一种工艺流程如图所示:

①电弧炉中发生反应的化学方程式为_______ ,当有1molC参加反应,理论上转移的电子数是_______  。
。
② 中Si的化合价为
中Si的化合价为_______ ,它与水反应生成两种酸,其反应化学方程式为_______ 。
③在流化床反应的产物中,除 外,还有
外,还有 、
、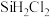 、
、 、
、 等,有关物质的沸点数据如下表所示,分离
等,有关物质的沸点数据如下表所示,分离 和其他杂质的方法为
和其他杂质的方法为_______ 。
④分离出 后的残余物中含有铁元素,为了测定残余物中铁元素的含量,先将残余物预处理,使铁元素还原成
后的残余物中含有铁元素,为了测定残余物中铁元素的含量,先将残余物预处理,使铁元素还原成 ,再用酸性
,再用酸性 溶液与其反应,反应的离子方程式为
溶液与其反应,反应的离子方程式为_______ ,某同学称取1.000g残余物,经预处理后配制成100mL溶液,移取20.00mL试样溶液,用 酸性
酸性 溶液与其反应,
溶液与其反应, 溶液恰好褪色时,消耗酸性
溶液恰好褪色时,消耗酸性 溶液20.00mL,则残余物中铁元素的质量分数是
溶液20.00mL,则残余物中铁元素的质量分数是_______ 。
(1)写出硅在元素周期表中的位置
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(
 ,铜为+2价),则x=
,铜为+2价),则x=(3)工业上提纯硅有多种路线,其中一种工艺流程如图所示:

①电弧炉中发生反应的化学方程式为
 。
。②
 中Si的化合价为
中Si的化合价为③在流化床反应的产物中,除
 外,还有
外,还有 、
、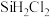 、
、 、
、 等,有关物质的沸点数据如下表所示,分离
等,有关物质的沸点数据如下表所示,分离 和其他杂质的方法为
和其他杂质的方法为| 物质 |  |  |  | 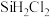 | 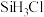 |  |  |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | 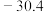 | 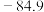 |  |
④分离出
 后的残余物中含有铁元素,为了测定残余物中铁元素的含量,先将残余物预处理,使铁元素还原成
后的残余物中含有铁元素,为了测定残余物中铁元素的含量,先将残余物预处理,使铁元素还原成 ,再用酸性
,再用酸性 溶液与其反应,反应的离子方程式为
溶液与其反应,反应的离子方程式为 酸性
酸性 溶液与其反应,
溶液与其反应, 溶液恰好褪色时,消耗酸性
溶液恰好褪色时,消耗酸性 溶液20.00mL,则残余物中铁元素的质量分数是
溶液20.00mL,则残余物中铁元素的质量分数是
您最近一年使用:0次
8 . 下表显示了元素周期表中短周期的一部分,X、Y、Z、G、M、E代表6种短周期元素,请回答以下问题。
(1)E的元素符号是___________ ,其在元素周期表中的位置是___________ ,其原子结构示意图为___________ 。
(2)X的元素符号是___________ ,X的离子与Z的离子相比,半径关系是X___________ Z(填“>”“=”或“<”)。
(3) 的电子式为
的电子式为___________ (用元素符号表示,下同),其中所含化学键的类型是___________ 。
(4)用电子式表示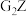 的形成过程
的形成过程___________ 。
(5)M的最高价氧化物对应的水化物与G的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(6)上述6种元素中,金属性最强的是___________ 。
| X | Y | Z | |||||
| G | M | E |
(2)X的元素符号是
(3)
 的电子式为
的电子式为(4)用电子式表示
 的形成过程
的形成过程(5)M的最高价氧化物对应的水化物与G的最高价氧化物对应的水化物发生反应的离子方程式是
(6)上述6种元素中,金属性最强的是
您最近一年使用:0次
9 . 下表显示了元素周期表中短周期的一部分,D、E、G、Q、M、X代表6种短周期元素,请回答以下问题。
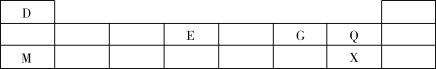
(1)E在元素周期表中的位置是第___________ 周期,第___________ 族,其原子结构示意图为___________ 。
(2)G的元素符号是___________ ,M的元素符号是___________ ,二者原子半径的关系是:G___________ M(填“>”“=”或“<”)。
(3)由M、X组成的化合物的电子式为___________ (用元素符号表示,下同),它属于___________ 化合物(填“离子”或“共价”)。
(4)用电子式表示DX的形成过程___________ ,DX中所含化学键的类型是___________ 。
(5)上述6种元素中,非金属性最强的是___________ 。

(1)E在元素周期表中的位置是第
(2)G的元素符号是
(3)由M、X组成的化合物的电子式为
(4)用电子式表示DX的形成过程
(5)上述6种元素中,非金属性最强的是
您最近一年使用:0次
10 . 元素周期律和周期表是我们研究、预测物质性质的重要工具。下表是元素周期表中前四周期的5种元素的相关信息。
回答下列问题:
(1)D在元素周期表中的位置是___________ 。
(2)BH4的分子结构模型为___________ ,其气态氢化物的稳定性BH4___________ HD(填写“大于”“小于”或“等于”)。
(3)少量E的单质加入水中剧烈反应,反应的化学方程式是___________ ;将一块C单质加入上述形成的强碱溶液中反应的离子方程式是___________ ;元素A、E的最高价氧化物对应的水化物中,碱性更强的物质是___________ (填写化学式)。
(4)下列曲线分别表示元素的某种性质(用Y表示)与核电荷数(用Z表示)的关系。请将正确曲线的图象标号填入相应的空格中:
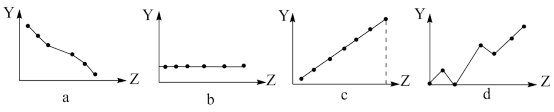
第IIA族元素的最外层电子数____ ,第三周期主族元素的最高正化合价___ 。
| 元素 | 元素性质或原子结构 |
| A | 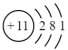 |
| B | B能形成多种单质,其中一种单质是硬度最大的物质 |
| C | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
| D | D的单质是一种黄绿色气体 |
| E | 用E的碳酸盐做焰色试验时火焰为紫色(透过蓝色钴玻璃片) |
(1)D在元素周期表中的位置是
(2)BH4的分子结构模型为
(3)少量E的单质加入水中剧烈反应,反应的化学方程式是
(4)下列曲线分别表示元素的某种性质(用Y表示)与核电荷数(用Z表示)的关系。请将正确曲线的图象标号填入相应的空格中:

第IIA族元素的最外层电子数
您最近一年使用:0次



