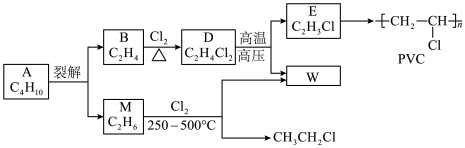
1 . 乙烯是石油化学工业重要的基本原料,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。例如可以合成聚氯乙烯(PVC)和用作汽油抗震剂的CH3CH2Cl。_______ 。
(2)B→D的反应类型是_______ 。
(3)E的结构简式是_______ 。
(4)M→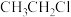 的反应方程式是
的反应方程式是_______ 。
(2)B→D的反应类型是
(3)E的结构简式是
(4)M→
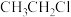 的反应方程式是
的反应方程式是
您最近一年使用:0次
7日内更新
|
160次组卷
|
2卷引用:北京工业大学附属中学2023-2024学年高一下学期期中考试化学试题
2 . 已知: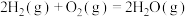
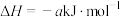
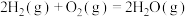
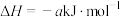

A.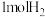 与 与 反应生成水放出的热量为akJ 反应生成水放出的热量为akJ |
B.氢分子变为氢原子需要放出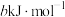 的热量 的热量 |
C.断开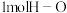 键需要的能量为 键需要的能量为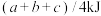 |
D.可通过a、b、c的具体数值判断 键与 键与 键的相对牢固程度 键的相对牢固程度 |
您最近一年使用:0次
7日内更新
|
81次组卷
|
2卷引用:北京市第五中学2023-2024学年高一下学期期中考试化学试题
名校
3 . 化学电池的发明,是贮能和供能技术的巨大进步。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应___________ 。
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为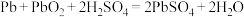 。放电时,正极的电极反应是
。放电时,正极的电极反应是___________ ,当外电路通过0.5mol电子时,理论上负极板的质量增加___________ g。 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为___________ 。___________ 。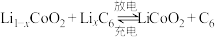 (x<1)。已知A为石墨
(x<1)。已知A为石墨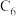 电极,则下图所示是
电极,则下图所示是___________ (填“充电”或“放电”)过程,B电极上的反应为___________ 。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为
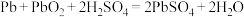 。放电时,正极的电极反应是
。放电时,正极的电极反应是
 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为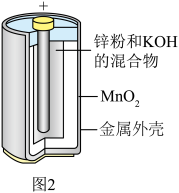
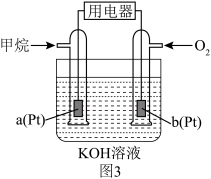
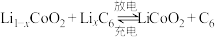 (x<1)。已知A为石墨
(x<1)。已知A为石墨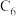 电极,则下图所示是
电极,则下图所示是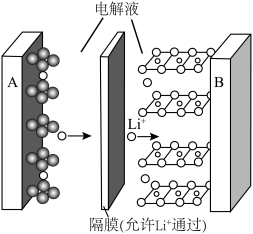
您最近一年使用:0次
4 . 硒(Se)是动物和人体所必需的微量元素,硒单质是一种重要的工业原料。
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,___________ 。
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为___________ 。
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,___________ ,___________ ,得电子能力Br大于Se.
(4)依据元素周期律,下列推断正确的是___________ (填字母)。
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,
(4)依据元素周期律,下列推断正确的是
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
您最近一年使用:0次
5 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
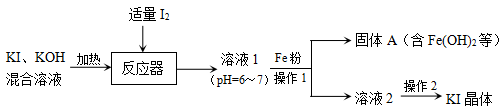
6 . KI广泛用于皮肤科、眼科等疾病的治疗,可以利用海水中获得的I2与KI、KOH的混合溶液为原料制备KI,流程如下:
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
(1)溶液1中的溶质主要为KI、___________ (填化学式)。
(2)使用粉末状的铁能加快反应速率,原因是___________ 。
(3)用文字描述Fe所起的作用是___________ 。
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:___________ 、___________ 。
(5)操作2是___________ ,过滤,洗涤,干燥。
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
| 温度/℃ | 6 | 20 | 60 | 100 |
| KI溶解度/g | 128 | 140 | 176 | 206 |
(2)使用粉末状的铁能加快反应速率,原因是
(3)用文字描述Fe所起的作用是
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:
(5)操作2是
您最近一年使用:0次
7 . 选择完成下列实验的装置。___________ (填序号,下同)。
(2)比较Na2CO3和NaHCO3的热稳定性,选用___________ 。
(3)加热MnO2和浓盐酸的混合物制Cl2,选用___________ 。
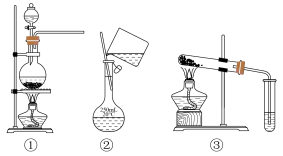
(2)比较Na2CO3和NaHCO3的热稳定性,选用
(3)加热MnO2和浓盐酸的混合物制Cl2,选用
您最近一年使用:0次
8 . 阅读短文,回答问题。
2022年北京冬奥会不仅是一次体育盛会,也是一场科技与创新的盛宴。在服装材料方面,颁奖礼仪服的内胆里添加了第二代石墨烯(如图)发热材料,能带来由内而外的温暖;速滑竞赛服使用了蜂窝样式的聚氨酯材料,以减少空气阻力。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)石墨烯中原子之间存在共价键。(___________)
(2)聚氨酯材料属于有机高分子材料。(___________)
(3)碳纤维导热性比金属材料的高。(___________)
(4)氢气是比烷烃更低碳环保的清洁能源。(___________)
2022年北京冬奥会不仅是一次体育盛会,也是一场科技与创新的盛宴。在服装材料方面,颁奖礼仪服的内胆里添加了第二代石墨烯(如图)发热材料,能带来由内而外的温暖;速滑竞赛服使用了蜂窝样式的聚氨酯材料,以减少空气阻力。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)石墨烯中原子之间存在共价键。(___________)
(2)聚氨酯材料属于有机高分子材料。(___________)
(3)碳纤维导热性比金属材料的高。(___________)
(4)氢气是比烷烃更低碳环保的清洁能源。(___________)
您最近一年使用:0次
名校
解题方法
9 . 海水是巨大的资源宝库。
Ⅰ海带中含有碘元素,从海带中提取碘的实验过程如下图所示___________ 。
(2)步骤④中的氧化剂可使用 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(3)步骤⑤中可用苯做萃取剂,理由有___________ (填序号)
a.苯与水不能互溶
b.碘单质在苯中的溶解度远大于在水中的溶解度
c.苯是无色液体
Ⅱ通过传统的海带提碘工艺后,所得卤水中的碘元素可通过以下流程回收利用: 溶液只能将I-氧化为
溶液只能将I-氧化为 ,同时生成NO
,同时生成NO
ⅱ将湿润的淀粉KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(4)写出氧化含 的卤水中发生的离子方程式:
的卤水中发生的离子方程式:___________ 。
(5)分离操作X的装置如图所示,电加热器的作用是,得到 的位置位于该装置中
的位置位于该装置中___________ 处(填图中选项)。 的氧化性强于
的氧化性强于 ,但该方法中却选择了价格较高的
,但该方法中却选择了价格较高的 ,原因是
,原因是______ 。
Ⅲ碘水可以用来测定溶液中的 浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
已知:
(7)已知标准 溶液的浓度和消耗的体积分别为c和V,计算待测液中
溶液的浓度和消耗的体积分别为c和V,计算待测液中 浓度还需要的实验数据有
浓度还需要的实验数据有___________ 。
Ⅰ海带中含有碘元素,从海带中提取碘的实验过程如下图所示

(2)步骤④中的氧化剂可使用
 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)步骤⑤中可用苯做萃取剂,理由有
a.苯与水不能互溶
b.碘单质在苯中的溶解度远大于在水中的溶解度
c.苯是无色液体
Ⅱ通过传统的海带提碘工艺后,所得卤水中的碘元素可通过以下流程回收利用:

 溶液只能将I-氧化为
溶液只能将I-氧化为 ,同时生成NO
,同时生成NOⅱ将湿润的淀粉KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(4)写出氧化含
 的卤水中发生的离子方程式:
的卤水中发生的离子方程式:(5)分离操作X的装置如图所示,电加热器的作用是,得到
 的位置位于该装置中
的位置位于该装置中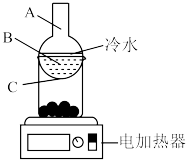
 的氧化性强于
的氧化性强于 ,但该方法中却选择了价格较高的
,但该方法中却选择了价格较高的 ,原因是
,原因是Ⅲ碘水可以用来测定溶液中的
 浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。已知:

(7)已知标准
 溶液的浓度和消耗的体积分别为c和V,计算待测液中
溶液的浓度和消耗的体积分别为c和V,计算待测液中 浓度还需要的实验数据有
浓度还需要的实验数据有
您最近一年使用:0次
名校
解题方法
10 . 《自然》杂志报道了一种铝离子电池,该电池的电解质为含有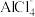 的有机离子液体(有机离子不参与反应),放电时泡沫石墨电极中释放
的有机离子液体(有机离子不参与反应),放电时泡沫石墨电极中释放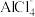 。下列说法不正确的是
。下列说法不正确的是
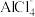 的有机离子液体(有机离子不参与反应),放电时泡沫石墨电极中释放
的有机离子液体(有机离子不参与反应),放电时泡沫石墨电极中释放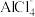 。下列说法不正确的是
。下列说法不正确的是
| A.泡沫石墨电极上发生还原反应 |
B.负极的电极反应式: |
| C.放电时,有机阳离子向石墨电极方向移动 |
| D.当铝电极质量减少2.7g时,石墨电极质量减少16.9g |
您最近一年使用:0次




