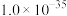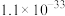1 . 唑草酮是一种广谱除草剂,在农业上应用范围比较广,除草效果比较好。唑草酮的一种合成路线如下图。 是一种叠氮化试剂。
是一种叠氮化试剂。
回答下列问题:
(1)C中官能团的名称为___________ 。
(2)由A生成C的反应类型为___________ ,该反应的目的是___________ 。
(3) 的化学方程式为
的化学方程式为___________ 。
(4)已知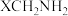 中
中 键的极性越大,则
键的极性越大,则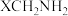 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为___________ (填标号)。___________ 种。
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有
(6)化合物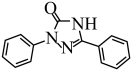 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为___________ 和___________ 。

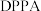 是一种叠氮化试剂。
是一种叠氮化试剂。回答下列问题:
(1)C中官能团的名称为
(2)由A生成C的反应类型为
(3)
 的化学方程式为
的化学方程式为(4)已知
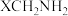 中
中 键的极性越大,则
键的极性越大,则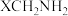 的碱性越弱。下列物质的碱性由强到弱的顺序为
的碱性越弱。下列物质的碱性由强到弱的顺序为a. 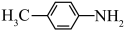 b.
b. 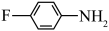 c.
c.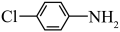
①含有苯环,且苯环上有3个取代基
②能发生银镜反应
③含有
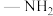
(6)化合物
 的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
的合成路线如下图(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
7日内更新
|
181次组卷
|
2卷引用:2024届黑龙江省齐齐哈尔市高三下学期三模化学试题
解题方法
2 . 2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应 ;
;
反应ii: 。
。
(1)反应体系中存在反应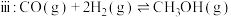 ,则
,则
____________  。
。
(2)将 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为____________ 。(计算结果保留三位有效数字)。
(2) 轴上
轴上 点的数值比
点的数值比 点
点____________ (填“大”或“小”)。
(3)在不同压强下,按照 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和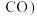 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: 由大到小的顺序为
由大到小的顺序为____________ 。
②曲线____________ (填“ ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。
③在 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
____________ (填含 的表达式)。
的表达式)。
(4)光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
①光催化原理与电解原理类似,写出高能导带的电极反应式:____________ 。
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成____________ (填写微粒名称)参与 的还原再生。
的还原再生。
 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应
 ;
;反应ii:
 。
。(1)反应体系中存在反应
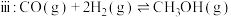 ,则
,则
 。
。(2)将
 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: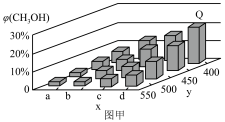
 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(2)
 轴上
轴上 点的数值比
点的数值比 点
点(3)在不同压强下,按照
 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: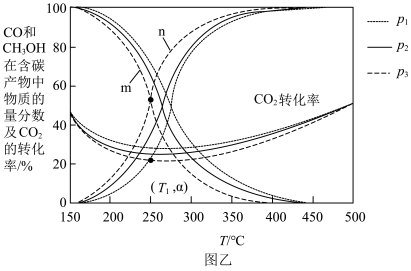
 由大到小的顺序为
由大到小的顺序为②曲线
 ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。③在
 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
 的表达式)。
的表达式)。(4)光催化
 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。①光催化原理与电解原理类似,写出高能导带的电极反应式:
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成
 的还原再生。
的还原再生。
您最近一年使用:0次
2024-04-16更新
|
396次组卷
|
2卷引用:黑龙江省部分学校2024届高三第二次模拟考试化学试题
名校
解题方法
3 . 依折麦布(J)和辛伐他汀(K)是两种重要的调脂药,依折麦布的合成路线如下,部分条件省略。
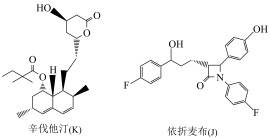
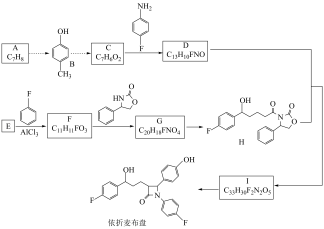
已知:①
②B生成C经过多步反应,C能发生银镜反应
请回答下列问题:
(1)J、K中具有的相同官能团的结构式是______ 。
(2)A、B、C的沸点由大到小的顺序是______ 。
(3)D中含有“ ”基团,写出C→D的化学方程式
”基团,写出C→D的化学方程式______ 。
(4)H的分子式为______ , 的反应类型为
的反应类型为______ 。
(5)已知E的质谱图中最大质荷比数值为114,核磁共振氢谱峰面积之比为2∶1,则E的结构简式为______ 。
(6)K、J中有多种环状结构,某五元环状化合物L是K中“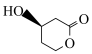 ”结构的同类别异构体,写出一种只含一个手性碳原子的L的结构简式:
”结构的同类别异构体,写出一种只含一个手性碳原子的L的结构简式:______ 。
(7)题中的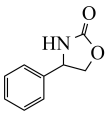 (M),可由某分子N脱去一分子水得到,N可以为
(M),可由某分子N脱去一分子水得到,N可以为______ 。


已知:①

②B生成C经过多步反应,C能发生银镜反应
请回答下列问题:
(1)J、K中具有的相同官能团的结构式是
(2)A、B、C的沸点由大到小的顺序是
(3)D中含有“
 ”基团,写出C→D的化学方程式
”基团,写出C→D的化学方程式(4)H的分子式为
 的反应类型为
的反应类型为(5)已知E的质谱图中最大质荷比数值为114,核磁共振氢谱峰面积之比为2∶1,则E的结构简式为
(6)K、J中有多种环状结构,某五元环状化合物L是K中“
 ”结构的同类别异构体,写出一种只含一个手性碳原子的L的结构简式:
”结构的同类别异构体,写出一种只含一个手性碳原子的L的结构简式:(7)题中的
 (M),可由某分子N脱去一分子水得到,N可以为
(M),可由某分子N脱去一分子水得到,N可以为
您最近一年使用:0次
名校
解题方法
4 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
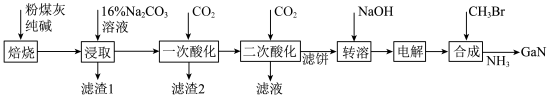
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度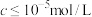 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: 可溶于氨水中,
可溶于氨水中,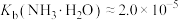 ,反应
,反应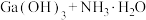
 的平衡常数
的平衡常数 ,计算反应
,计算反应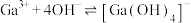 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
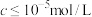 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
 可溶于氨水中,
可溶于氨水中,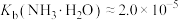 ,反应
,反应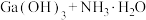
 的平衡常数
的平衡常数 ,计算反应
,计算反应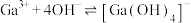 的平衡常数
的平衡常数
您最近一年使用:0次
名校
解题方法
5 . 铟( )是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铜烟灰中(主要含
)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铜烟灰中(主要含 、
、 、
、 、
、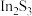 、
、 )提取铟的工艺流程如下:
)提取铟的工艺流程如下:

已知:氧化浸出后铟元素主要以 形式存在,性质与
形式存在,性质与 相似。
相似。
回答下列问题:
(1)写出元素 在周期表中的位置:
在周期表中的位置:___________ ,属于___________ 区元系。
(2)“氧化浸出”工艺中,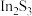 的硫元素被氧化为
的硫元素被氧化为 ,写出
,写出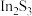 发生反应的离子方程式:
发生反应的离子方程式:___________ 。
(3)“滤渣”的主要成分是___________ 。
(4)“水相”中主要存在的金属离子是 ,经提纯后可将溶液用于铜的电镀实验,电镀前还须滴加浓氨水至溶液为深蓝色,目的是
,经提纯后可将溶液用于铜的电镀实验,电镀前还须滴加浓氨水至溶液为深蓝色,目的是___________ 。
(5)“萃取”工艺中,加入 时,发现当溶液
时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是___________ 。
(6)太阳能材料 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知A处
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知A处 原子坐标为(0.5,0,0.25),B处
原子坐标为(0.5,0,0.25),B处 原子坐标为(0,0.5,0.25)。
原子坐标为(0,0.5,0.25)。

①C处S原子坐标为___________ 。
②设该晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ 。
 )是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铜烟灰中(主要含
)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铜烟灰中(主要含 、
、 、
、 、
、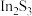 、
、 )提取铟的工艺流程如下:
)提取铟的工艺流程如下:
已知:氧化浸出后铟元素主要以
 形式存在,性质与
形式存在,性质与 相似。
相似。回答下列问题:
(1)写出元素
 在周期表中的位置:
在周期表中的位置:(2)“氧化浸出”工艺中,
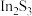 的硫元素被氧化为
的硫元素被氧化为 ,写出
,写出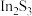 发生反应的离子方程式:
发生反应的离子方程式:(3)“滤渣”的主要成分是
(4)“水相”中主要存在的金属离子是
 ,经提纯后可将溶液用于铜的电镀实验,电镀前还须滴加浓氨水至溶液为深蓝色,目的是
,经提纯后可将溶液用于铜的电镀实验,电镀前还须滴加浓氨水至溶液为深蓝色,目的是(5)“萃取”工艺中,加入
 时,发现当溶液
时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(6)太阳能材料
 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知A处
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知A处 原子坐标为(0.5,0,0.25),B处
原子坐标为(0.5,0,0.25),B处 原子坐标为(0,0.5,0.25)。
原子坐标为(0,0.5,0.25)。
①C处S原子坐标为
②设该晶体密度为
 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2023-03-12更新
|
782次组卷
|
4卷引用:黑龙江省 牡丹江市第二高级中学2023-2024学年高三上学期12月月考化学试题
黑龙江省 牡丹江市第二高级中学2023-2024学年高三上学期12月月考化学试题重庆市南开中学校2023届高三第七次质量检测化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(工业流程题)(已下线)广东省广州市天河区2023届高三二模化学试题变式题(工业流程题)
名校
6 . 葡萄糖酸钙是一种有机钙盐,外观为白色结晶性或颗粒性粉末,无臭,无味,易溶于沸水,微溶于冷水,不溶于乙醇或乙醚等有机溶剂。葡萄糖酸钙临床上用于治疗骨质疏松症。实验室制备葡萄糖酸钙主要步骤如下:
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
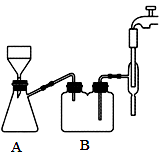
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。
回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为_______ 。
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是_______ 。
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是_______ ;装置 B 的作用是_______ 。
(4)洗涤操作洗涤剂最合适的是_______ _(填序号),理由是_______ 。
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色) MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+
Mg2+ + H2Y2- MgY2- + 2H+
MgY2- + 2H+
MgIn-(酒红色)+ H2Y2- MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色)
(iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN- Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是_______ 。
(6)滴定终点的颜色变化为_______ 。
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为_______ ,_______ 。
(8)葡萄糖酸钙中钙的质量分数为_______ 。(用 V1、V2、m、c 的代数式表示)
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。

回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
(4)洗涤操作洗涤剂最合适的是
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色)
 MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+ Mg2+ + H2Y2-
 MgY2- + 2H+
MgY2- + 2H+ MgIn-(酒红色)+ H2Y2-
 MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色) (iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN-
 Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是
(6)滴定终点的颜色变化为
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为
(8)葡萄糖酸钙中钙的质量分数为
您最近一年使用:0次