1 .  是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
 是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是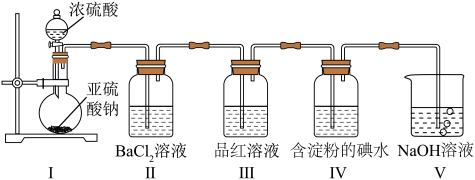
| A.装置Ⅰ中浓硫酸体现强氧化性 |
| B.装置Ⅱ无明显变化,实验结束后向其中通入空气,也无明显变化 |
C.装置Ⅲ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有氧化性 具有氧化性 |
| D.装置V中使用酸性高锰酸钾溶液也可达到实验目的 |
您最近一年使用:0次
2 . 科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:___________ 。
(2)装置A中设计g管的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
(4)由实验1、2现象可以得出结论:增大pH,___________ 优先于___________ 放电;
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是___________ ;
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验___________ 作对照实验;
③实验目的ii是___________ ;
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:___________ 。
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:
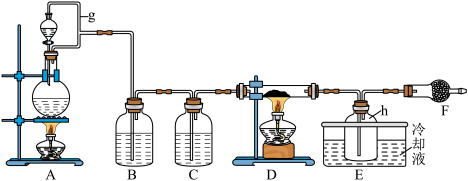
(2)装置A中设计g管的作用是
(3)装置A中发生反应的离子方程式为
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
| 实验编号 | 电压/V | pH | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 1.00 | 无气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
| 2 | 1.5 | 5.52 | 无气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 3 | 3.0 | 5.52 | 少量气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 4 | 4.5 | 5.52 | 大量气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
(4)由实验1、2现象可以得出结论:增大pH,
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
| 实验编号 | c(NH4Cl)/mol·L-1 | 温度/℃ | 待测物理量X | 实验目的 |
| 5 | 0.5 | 30 | a | ___________ |
| 6 | 1.5 | i | b | 探究浓度对氯化铵水解平衡的影响 |
| 7 | 1.5 | 35 | c | ii |
| 8 | 2.0 | 40 | d | 探究温度、浓度同时对氯化铵化解平衡的影响 |
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验
③实验目的ii是
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:
您最近一年使用:0次
名校
3 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为___________ g。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到___________ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:___________ 。
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____ +_________。
+_________。
该反应完毕的现象标志是___________ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是___________ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
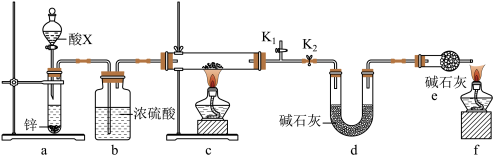
①装置a中所加的酸X是___________ (填化学式)。
②通过测定下列物理量,能达到实验目的的是___________ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是___________ 。
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____
 +_________。
+_________。该反应完毕的现象标志是
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
您最近一年使用:0次
名校
解题方法
4 . 下列实验操作或装置能达到相应实验目的的是
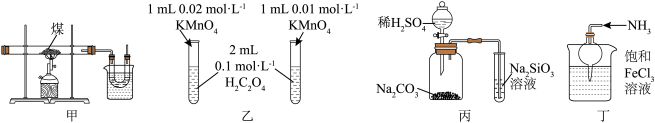

| A.取图甲实验后U形管中液体,加入FeCl3溶液后呈紫色,证明煤中有酚类物质 |
| B.图乙通过观察高锰酸钾溶液褪色时间,探究反应物浓度对化学反应速率的影响 |
| C.通过图丙实验现象,验证非金属性S>C>Si |
| D.利用图丁装置及试剂制备Fe(OH)3胶体 |
您最近一年使用:0次
2023-09-07更新
|
195次组卷
|
3卷引用:河北省秦皇岛市部分学校2023-2024学年高三上学期开学联考化学试题
5 . 下列装置(部分夹持装置略去)中仪器使用规范且能达到实验目的的是
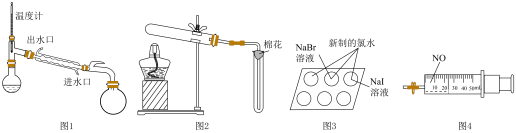
| A.图1:采用蒸馏法分离正己烷(沸点69℃)和正庚烷(沸点98℃) |
B.图2:用 和 和 制备并收集 制备并收集 |
| C.图3:通过观察实验现象,验证氯、溴和碘元素性质的递变规律 |
D.图4:利用该装置实现NO、 和 和 充分反应转化为 充分反应转化为 |
您最近一年使用:0次
2024-05-14更新
|
92次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
名校
6 . 科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
Ⅰ. 在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水
在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水 。经查阅资料得知:无水
。经查阅资料得知:无水 在空气中易潮解,加热易升华。他们设计了以Fe粉和
在空气中易潮解,加热易升华。他们设计了以Fe粉和 为原料制备无水
为原料制备无水 的实验方案,装置示意图如下:
的实验方案,装置示意图如下:
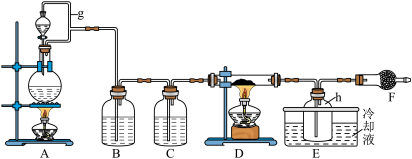
(1)仪器F的名称是___________ 。
(2)装置A中设计g管的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
Ⅱ.利用惰性电极电解 溶液,探究外界条件对电极反应(离子放电顺序)的影响。
溶液,探究外界条件对电极反应(离子放电顺序)的影响。
(4)实验数据如表所示:
①由实验1、2现象可以得出结论:增大pH,___________ 优先于___________ 放电;
②若由实验2、3、4现象可以得出结论:___________ 。
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、 硝酸银溶液、蒸馏水和各种浓度的
硝酸银溶液、蒸馏水和各种浓度的 溶液。
溶液。
①实验中,“待测物理量X”是___________ ;
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验___________ 作对照实验;
③实验目的ⅱ是___________ ;
④上述表格中,b___________ d(填“>”、“<”或“=”)。
⑤氯化铵在生产生活中有很多实用的用途,请写出一种应用:___________ 。
Ⅰ.
 在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水
在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水 。经查阅资料得知:无水
。经查阅资料得知:无水 在空气中易潮解,加热易升华。他们设计了以Fe粉和
在空气中易潮解,加热易升华。他们设计了以Fe粉和 为原料制备无水
为原料制备无水 的实验方案,装置示意图如下:
的实验方案,装置示意图如下:
(1)仪器F的名称是
(2)装置A中设计g管的作用是
(3)装置A中发生反应的离子方程式为
Ⅱ.利用惰性电极电解
 溶液,探究外界条件对电极反应(离子放电顺序)的影响。
溶液,探究外界条件对电极反应(离子放电顺序)的影响。(4)实验数据如表所示:
| 实验编号 | 电压/V | pH | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 1.00 | 无气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
| 2 | 1.5 | 5.52 | 无气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 3 | 3.0 | 5.52 | 少量气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 4 | 4.5 | 5.52 | 大量气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
②若由实验2、3、4现象可以得出结论:
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
| 实验编号 |  | 温度/℃ | 待测物理量X | 实验目的 |
| 5 | 0.5 | 30 | a | ___________ |
| 6 | 1.5 | ⅰ | b | 探究浓度对氯化铵水解平衡的影响 |
| 7 | 1.5 | 35 | c | ⅱ |
| 8 | 2.0 | 40 | d | 探究温度、浓度同时对氯化铵化解平衡的影响 |
 硝酸银溶液、蒸馏水和各种浓度的
硝酸银溶液、蒸馏水和各种浓度的 溶液。
溶液。①实验中,“待测物理量X”是
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验
③实验目的ⅱ是
④上述表格中,b
⑤氯化铵在生产生活中有很多实用的用途,请写出一种应用:
您最近一年使用:0次
2023-09-28更新
|
246次组卷
|
2卷引用:广东省部分学校(南粤名校联考)2023-2024学年高三上学期9月联考化学试题
名校
7 . 利用下列装置进行实验,能达到实验目的的是
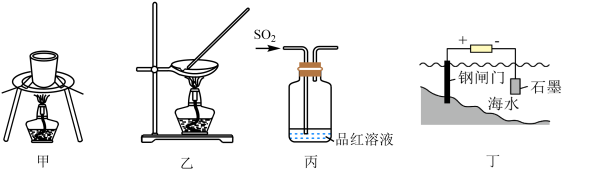

| A.甲装置加热金属钠观察钠燃烧的现象 |
B.乙装置蒸发 溶液制备无水 溶液制备无水 固体 固体 |
C.丙装置验证 的酸性 的酸性 |
| D.丁装置应用电化学原理对钢闸门进行防护 |
您最近一年使用:0次
2023-09-09更新
|
71次组卷
|
2卷引用:山西省运城市2023-2024学年高三上学期开学考试化学试题
2023·全国·模拟预测
解题方法
8 . 为完成各组实验,下列所选试剂、实验操作方法和实验现象的描述均正确的是
| 选项 | 实验目的 | 试剂 | 操作方法 | 实验现象 |
| A | 制备 并检验其性质 并检验其性质 | 浓氨水、蒸馏水、pH试纸 | 加热浓氨水,用湿润的pH试纸检验逸出的气体 | 浓氮水冒气泡,pH试纸变蓝 |
| B | 检验溴乙烷中含溴元素 | 溴乙烷、KOH溶液、 溶液 溶液 | 加热溴乙烷与KOH的混合液,然后滴加 溶液 溶液 | 有淡黄色沉淀生成 |
| C | 钠盐的焰色试验 |  溶液、稀硫酸 溶液、稀硫酸 | 用铂丝蘸取稀硫酸,并在酒精灯火焰上灼烧,然后再蘸取 溶液灼烧 溶液灼烧 | 焰色为黄色 |
| D | 探究金属腐蚀类型 | NaCl溶液、铁钉 | 将铁钉用NaCl溶液浸泡,然后放入气密性良好的下列装置中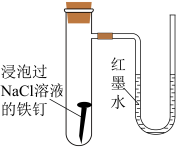 | U形管中红墨水右端高、左端低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
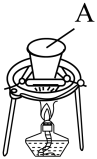
(1)A可选用_______ (填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为_______ 。
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为_______ ;检验K2MnO4歧化完全的实验方法是_______ 。
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应: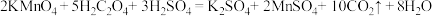 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]
(4)配制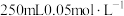 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是_______ (填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于_______ 。
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:
_______ 。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。

(1)A可选用
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:
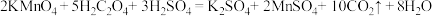 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录的数据]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
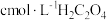 溶液 溶液 |  | 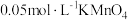 溶液 溶液 | 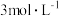 稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
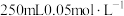 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:

您最近一年使用:0次
2023-05-11更新
|
326次组卷
|
3卷引用:辽宁省抚顺市重点高中六校协作体2023届高三下学期二模联考化学试题
10 .  具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:
(1)用如图1装置(夹持仪器已省略)验证 具有氧化性。
具有氧化性。 的名称为
的名称为___________ 。
②装置甲试管中反应的离子方程式为___________ 。
③说明 具有氧化性的现象为
具有氧化性的现象为___________ 。
(2)该同学设计如图2所示装置(夹持仪器已省略)制备 (难溶解于水中)。
(难溶解于水中)。 的作用是
的作用是___________ 。
②三颈烧瓶中反应的化学方程式为___________ 。
(3)该实验体现了 的性质是
的性质是___________ 。
(4)实验表明,将纯净的 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
假设Ⅰ:溶液中的 ;
;
假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
实验i现象为___________ ,实验ii的现象为___________ 。
②验证假设Ⅱ。请完成下列表格:
实验iv的步骤为___________ ,实验目的是___________ 。
 具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:(1)用如图1装置(夹持仪器已省略)验证
 具有氧化性。
具有氧化性。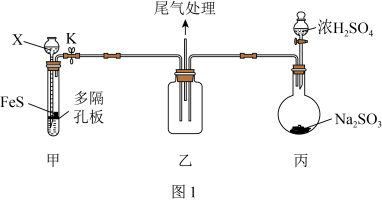
 的名称为
的名称为②装置甲试管中反应的离子方程式为
③说明
 具有氧化性的现象为
具有氧化性的现象为(2)该同学设计如图2所示装置(夹持仪器已省略)制备
 (难溶解于水中)。
(难溶解于水中)。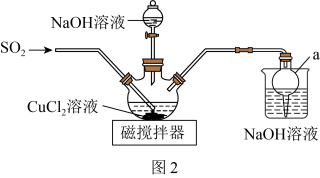
 的作用是
的作用是②三颈烧瓶中反应的化学方程式为
(3)该实验体现了
 的性质是
的性质是(4)实验表明,将纯净的
 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:假设Ⅰ:溶液中的
 ;
;假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
实验 | 向 溶液中缓慢通入纯净的 溶液中缓慢通入纯净的 气体 气体 | 假设I成立 | |
实验 | 向 溶液的烧杯中缓慢通入纯净的 溶液的烧杯中缓慢通入纯净的 气体 气体 |
②验证假设Ⅱ。请完成下列表格:
| 实验步骤 | 实验现象 | 实验目的 | |
| 实验iii | 同实验 步骤 步骤 | 同实验 的相关现象 的相关现象 | 作对照实验 |
| 实验iv | 产生白色沉淀 | ||
您最近一年使用:0次
2024-02-23更新
|
669次组卷
|
8卷引用:江西省部分学校2023-2024学年高三上学期2月月考化学试题
江西省部分学校2023-2024学年高三上学期2月月考化学试题四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届内蒙古自治区乌海市第六中学高三下学期第三次模拟考试理综试题-高中化学河南省郑州市第五高级中学2023-2024学年高三2月开学考理综试题-高中化学(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)四川省广元市川师大万达中学2023-2024学年高一下学期3月月考化学试题黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题



