真题
解题方法
1 . 磷酸二氢钾在工农业生产及国防工业等领域都有广泛的应用。某研究小组用质量分数为85%的磷酸与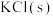 反应制备
反应制备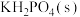 ,反应方程式为
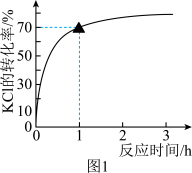
,反应方程式为 一定条件下的实验结果如图1所示。
一定条件下的实验结果如图1所示。
回答问题:
(1)该条件下,反应至1h时KCl的转化率为_______ 。
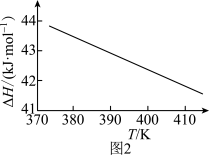
(2)该制备反应的 随温度变化关系如图2所示。该条件下反应为
随温度变化关系如图2所示。该条件下反应为_______ 反应(填“吸热”或“放热”),且反应热随温度升高而_______ 。
(3)该小组为提高转化率采用的措施中有:使用浓磷酸作反应物、向系统中不断通入水蒸气等。它们能提高转化率的原因是:不使用稀磷酸_______ ;通入水蒸气_______ 。
(4)298K时,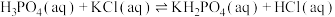 的平衡常数
的平衡常数
_______ 。(已知 的
的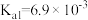 )
)
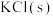 反应制备
反应制备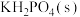 ,反应方程式为
,反应方程式为 一定条件下的实验结果如图1所示。
一定条件下的实验结果如图1所示。
回答问题:
(1)该条件下,反应至1h时KCl的转化率为
(2)该制备反应的
 随温度变化关系如图2所示。该条件下反应为
随温度变化关系如图2所示。该条件下反应为
(3)该小组为提高转化率采用的措施中有:使用浓磷酸作反应物、向系统中不断通入水蒸气等。它们能提高转化率的原因是:不使用稀磷酸
(4)298K时,
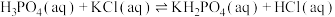 的平衡常数
的平衡常数
 的
的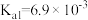 )
)
您最近一年使用:0次
真题
2 . 某小组开展“木耳中铁元素的检测”活动。检测方案的主要步骤有:粉碎、称量、灰化、氧化、稀释、过滤、滴定等。回答问题:
(1)实验方案中出现的图标 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者
,前者提示实验中会用到温度较高的设备,后者要求实验者_______ (填防护措施)。
(2)灰化:干燥样品应装入_______ 中(填标号),置高温炉内,控制炉温850℃,在充足空气氛中燃烧成灰渣。
a.不锈钢培养皿 b.玻璃烧杯 c.石英坩埚
(3)向灰渣中滴加32%的硝酸,直至没有气泡产生。灰化容器中出现的红棕色气体主要成分是_______ (填化学式),因而本实验应在实验室的_______ 中进行(填设施名称)。若将漏斗直接置于容量瓶上过滤收集滤液(如图所示),存在安全风险,原因是_______ 。

(4)测定铁含量基本流程:将滤液在200mL容量瓶中定容,移取25.00mL,驱尽 并将
并将 全部还原为
全部还原为 。用5mL微量滴定管盛装
。用5mL微量滴定管盛装 标准溶液进行滴定。
标准溶液进行滴定。
①选用微量滴定管的原因是_______ 。
②三次平行测定的数据如下表。针对该滴定数据,应采取的措施是_______ 。
③本实验中,使测定结果偏小的是_______ (填标号)。
a.样品未完全干燥 b.微量滴定管未用标准溶液润洗 c.灰渣中有少量炭黑
(1)实验方案中出现的图标
 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者
,前者提示实验中会用到温度较高的设备,后者要求实验者(2)灰化:干燥样品应装入
a.不锈钢培养皿 b.玻璃烧杯 c.石英坩埚
(3)向灰渣中滴加32%的硝酸,直至没有气泡产生。灰化容器中出现的红棕色气体主要成分是

(4)测定铁含量基本流程:将滤液在200mL容量瓶中定容,移取25.00mL,驱尽
 并将
并将 全部还原为
全部还原为 。用5mL微量滴定管盛装
。用5mL微量滴定管盛装 标准溶液进行滴定。
标准溶液进行滴定。①选用微量滴定管的原因是
②三次平行测定的数据如下表。针对该滴定数据,应采取的措施是
| 序号 | 1 | 2 | 3 |
| 标准溶液用量/mL | 2.715 | 2.905 | 2.725 |
a.样品未完全干燥 b.微量滴定管未用标准溶液润洗 c.灰渣中有少量炭黑
您最近一年使用:0次
2023-08-03更新
|
3886次组卷
|
6卷引用:2023年高考海南卷化学真题
2023年高考海南卷化学真题(已下线)实验综合题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型二 实验中常考滴定计算-备战2024年高考化学答题技巧与模板构建新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷
3 . 磷酸氢二铵[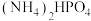 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备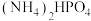 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。

回答问题:
(1)实验室用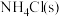 和
和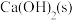 制备氨气的化学方程式为
制备氨气的化学方程式为_______ 。
(2)现有浓 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓
_______ mL(保留一位小数)。
(3)装置中活塞 的作用为
的作用为_______ 。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。
(4)当溶液pH为8.0~9.0时,停止通 ,即可制得
,即可制得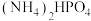 溶液。若继续通入
溶液。若继续通入 ,当
,当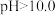 时,溶液中
时,溶液中 、
、_______ 和_______ (填离子符号)浓度明显增加。
(5)若本实验不选用pH传感器,还可选用_______ 作指示剂,当溶液颜色由_______ 变为_______ 时,停止通 。
。
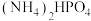 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备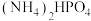 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。
回答问题:
(1)实验室用
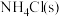 和
和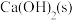 制备氨气的化学方程式为
制备氨气的化学方程式为(2)现有浓
 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓
(3)装置中活塞
 的作用为
的作用为 ,打开
,打开 。
。(4)当溶液pH为8.0~9.0时,停止通
 ,即可制得
,即可制得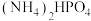 溶液。若继续通入
溶液。若继续通入 ,当
,当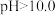 时,溶液中
时,溶液中 、
、(5)若本实验不选用pH传感器,还可选用
 。
。
您最近一年使用:0次
2022-07-04更新
|
8072次组卷
|
21卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题15-19(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第27讲 物质的制备与性质实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
4 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
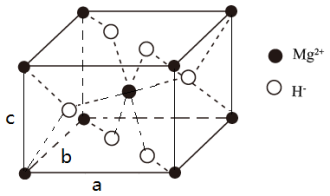
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4085次组卷
|
5卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)2020年海南卷化学高考真题变式题15-19(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
5 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
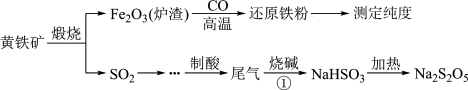
回答下列问题:
(1)黄铁矿中硫元素的化合价为_____________  。
。
(2)由炉渣制备还原铁粉的化学方程式为____________________________ 。
(3)欲得到更纯的NaHSO3,反应①应通入_____________ (填 “过量”或“不足量”)的SO2气体。
(4)因为Na2S2O5具有______________ 性, 导致商品Na2S2O5中不可避免地存在Na2SO4。
检验其中含有 的方法是
的方法是__________________ 。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。
反应式: +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
+6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
某次实验称取0.2800 g样品,滴定时消耗浓度为0.03000 mol·L-1的K2Cr2O7溶液25.10 mL,则样品中铁含量为____________________ %。

回答下列问题:
(1)黄铁矿中硫元素的化合价为
 。
。(2)由炉渣制备还原铁粉的化学方程式为
(3)欲得到更纯的NaHSO3,反应①应通入
(4)因为Na2S2O5具有
检验其中含有
 的方法是
的方法是(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。
反应式:
 +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
+6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O某次实验称取0.2800 g样品,滴定时消耗浓度为0.03000 mol·L-1的K2Cr2O7溶液25.10 mL,则样品中铁含量为
您最近一年使用:0次
2020-10-12更新
|
6411次组卷
|
13卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题15-19安徽省六安市城南中学2021届高三上学期第二次月考化学试题湖南省长沙市第一中学2020-2021学年高一下学期第一次月考化学试题(已下线)第3周 周测卷-备战2022年高考化学周测与晚练(新高考专用)重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习山西省运城市新康国际实验学校2021-2022学年高一下学期线上测试化学试题福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题江西省南昌市进贤县第一中学2022-2023学年高一下学期第一次月考化学试题(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖南省邵阳市第二中学2023-2024学年高一上学期第二次月考化学试题
真题
名校
6 . 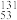 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中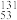 I的含量变化来检测核电站是否发生放射性物质泄漏,下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏,下列有关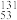 I的叙述中错误的是
I的叙述中错误的是
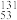 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中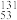 I的含量变化来检测核电站是否发生放射性物质泄漏,下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏,下列有关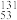 I的叙述中错误的是
I的叙述中错误的是A.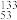 I的化学性质与 I的化学性质与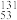 I相同 I相同 |
B.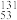 I的原子核外电子数为78 I的原子核外电子数为78 |
C.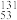 I的原子序数为53 I的原子序数为53 |
D.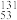 I的原子核内中子数多于质子数 I的原子核内中子数多于质子数 |
您最近一年使用:0次
2020-10-04更新
|
537次组卷
|
5卷引用:2011年普通高等学校招生全国统一考试化学(海南卷)
2011年普通高等学校招生全国统一考试化学(海南卷)上海市复旦大学附属中学2019-2020学年高一上学期期中考试化学试题(已下线)4.1.2 元素周期表(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.1.2 元素周期表-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)黑龙江省饶河县高级中学2022-2023学年高一上学期第二次月考化学试题
真题
名校
7 . 已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为:
| A.5个 | B.6个 | C.7个 | D.8个 |
您最近一年使用:0次
2019-01-30更新
|
1342次组卷
|
7卷引用:2009年普通高等学校招生统一考试化学试题(海南卷)
2009年普通高等学校招生统一考试化学试题(海南卷)2009高考真题汇编-糖类、油脂、蛋白质及合成材料(已下线)2010年辽宁省本溪市高二下学期期末考试化学(理)试题(已下线)2012-2013学年甘肃省兰州一中高二下学期期末考试化学试卷2019-2020学年人教版高中化学高考基础复习专题11《化学实验热点》测试卷(人教2019)选择性必修3第四章 第二节蛋白质吉林省长春市东北师范大学附属中学2022-2023学年高二下学期期末考试化学试题
真题
名校
8 . 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为_________________ :
(2)A与溴的四氯化碳溶液反应的化学方程式为___________ ,反应类型是_______ ;
(3)已知: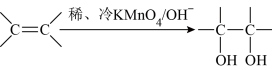 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式______________ ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式___________________________ ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________ 。
(1)A的分子式为
(2)A与溴的四氯化碳溶液反应的化学方程式为
(3)已知:
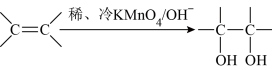 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为
您最近一年使用:0次
2019-01-30更新
|
108次组卷
|
5卷引用:2009年普通高等学校招生统一考试化学试题(海南卷)
真题
名校
9 . 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________ ;
(2)X与金属钠反应放出氢气,反应的化学方程式是____________ (有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是________________ ;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率为_____ 。
(1)X的分子式是
(2)X与金属钠反应放出氢气,反应的化学方程式是
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率为
您最近一年使用:0次
2019-01-30更新
|
1163次组卷
|
8卷引用:2007年普通高等学校招生全国统一考试(海南卷)化学试题
2007年普通高等学校招生全国统一考试(海南卷)化学试题(已下线)2010年江西省上高二中高二下学期期中考试化学试题(已下线)09—10年寿宁南阳高中高二下学期末考试化学卷2014-2015学年河南省三门峡市陕州中学高一下期末模拟化学试卷2016-2017学年福建省南安一中高二上10月月考化学试卷陕西省黄陵中学高新部2017-2018学年高二上学期期末考试化学试题专题3 有机化合物的获得与应用——B拓展区 综合拓展(苏教版必修2)北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
10 . 硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______ 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______ 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______ ;碳化硅又称_______ ,其晶体结构与_______ 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______ 。
③SiHCl3极易水解,其完全水解的产物为_______ 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______ 。
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

| 发生的主要反应 | |
| 电弧炉 | SiO2+2C Si+2CO↑ Si+2CO↑ |
| 流化床反应器 | Si+3HCl +SiHCl3+H2 +SiHCl3+H2 |
| 还原炉 | SiHCl3+H2 Si+3HCl Si+3HCl |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是
您最近一年使用:0次
2019-01-30更新
|
1594次组卷
|
5卷引用:2013年全国普通高等学校招生统一考试化学(海南卷)
2013年全国普通高等学校招生统一考试化学(海南卷)2015届河南省三门峡市陕州中学高三高考仿真训练(一)化学试卷(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第1讲 碳、硅及无机非金属材料 (题型专练)2020届高考化学二轮复习大题精准训练 ——侧重提纯类无机工艺流程题2020届高考化学二轮复习大题精准训练 —— 化学工艺流程题



