1 . 过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
32.第①步反应的化学方程式为________ 。第②步反应的化学方程式为________ 。
33.可循环使用的物质是_______ 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为______ 。
34.检验CaO2·8H2O是否洗净的方法是_______ 。
35.CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是______ 、______ 。
36.已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为_____ (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有_____ 。
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
32.第①步反应的化学方程式为
33.可循环使用的物质是
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为
34.检验CaO2·8H2O是否洗净的方法是
35.CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
36.已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
过氧化钙的含量也可用重量法测定,需要测定的物理量有
您最近一年使用:0次
真题
名校
2 . 硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:________________________________________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+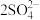 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。__________
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为__________ 。
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+
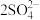 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
2012-11-23更新
|
1465次组卷
|
16卷引用:2012年上海市高考化学试题
2012年上海市高考化学试题(已下线)2013届浙江省乐清市第二中学高三第一次月考化学试卷(已下线)2012-2013学年湖北省部分重点中学高一秋季期中联考化学试卷(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届重庆市万州二中高三上学期9月月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2016届山西省晋中市四校高三上学期期中联考化学试卷2016届山西平遥中学等重点中学高三第三次练兵化学试卷2016届辽宁省实验中学分校高三上期中测试理综化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2018届高三一轮复习化学:考点14-氧化还原反应的计算山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题北京市第二十中学2018届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第一次月考化学试题
真题
名校
3 . 氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23%=35.453中
| A.75.77%表示35Cl的质量分数 | B.24.23%表示35Cl的丰度 |
| C.35.453表示氯元素的相对原子质量 | D.36.966表示37Cl的质量数 |
您最近一年使用:0次
2021-06-05更新
|
942次组卷
|
23卷引用:2011年上海市高考化学试题
2011年上海市高考化学试题上海市延安中学2017-2018学年高一上学期期中考试化学试题上海市2017-2018学年高一化学第一学期物质结构综合测试题上海中学2017-2018学年高一(上)期中化学试卷上海市浦东新区建平中学2016-2017学年高一(上)期中化学试卷上海市浦东新区2016-2017学年高一上学期期末考试化学试题上海市华二附中2017-2018高一第一学期期中化学试卷上海市复兴高级中学2019-2020学年高三上学期期中考试化学试题上海市部分重点高中2020-2021学年高一上学期10月阶段性测试化学试题上海市奉城高级中学2017-2018学年高一上学期期末考试化学试题上海交通大学附属中学2021-2022学年高一上学期摸底测试化学试题上海市风华中学2020-2021学年高三下学期第一次月考化学试题上海市实验学校2021-2022学年高一下学期线上教学阶段检测化学试题上海市华东理工大学附属闵行科技高级中学2021-2022学年高一上学期期中考试化学试题上海市宝山中学2022-2023学年高一上学期10月月考化学试题上海外国语大学附属大境中学2022-2023学年高一上学期期中考试化学试题上海市华东师范大学第三附属中学2022-2023学年高一上学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第二次月考化学试题2020年人教版高中化学必修2第一章《物质结构 元素周期律》测试卷(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 第1节 原子结构与元素性质 第1课时 原子核 核素云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题(已下线)专题15 原子结构 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第3讲 第一章章末复习-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)
4 . 用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
| A.试样中加入酚酞作指示剂,用标准酸液进行滴定 |
| B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| C.锥形瓶用蒸馏水洗涤后,直接注入待测溶液进行滴定 |
| D.取20.00mL标准酸液于锥形瓶中,滴定管用蒸馏水洗涤后,直接注入待测液进行滴定 |
您最近一年使用:0次
2020-10-13更新
|
790次组卷
|
19卷引用:2012年上海市高考化学试题
2012年上海市高考化学试题上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题(已下线)2011-2012学年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2013届江西省上饶市横峰中学高三第一次月考化学试卷2015-2016学年内蒙古赤峰二中高二上学期期末化学试卷(已下线)同步君 选修4 第3章 第2节 中和滴定2016-2017学年吉林省长春市第十一高中高二上学期期初考试化学试卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第一课时(中和滴定)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 作业帮人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时3 酸碱中和滴定吉林省四平市实验中学2020-2021学年高二12月月考化学试题(已下线)练习12 酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)选择性必修1(SJ)专题3第二单元课时2 酸碱中和滴定(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)吉林省长春市第二实验中学2021-2022学年高二上学期10月月考化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识3.2.2酸碱中和滴定 课中
真题
名校
5 . Na2SO3·7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na2SO3在30℃时的溶解度为35.5g/100gH2O。
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数
________ 。(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量___________ 。
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度__________ 。
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数
2)计算30℃时271g Na2SO3饱和溶液中水的质量
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度
您最近一年使用:0次
2020-08-21更新
|
142次组卷
|
4卷引用:2010年全国普通高等学校招生统一考试上海卷化学试题
真题
解题方法
6 . 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜。如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。

步骤二:碱式碳酸铜的制备。向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式____ 。
(2)上图装置中NaOH溶液的作用是__ 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____ (填写化学式)。
(3)步骤二中,水浴加热所需仪器有____ 、__ (加热、夹持仪器、石棉网除外);洗涤的目的是____ 。
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法_____ 。
(5)影响产品产量的主要因素有____ 。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____ 。
步骤一:废铜屑制硝酸铜。如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。

步骤二:碱式碳酸铜的制备。向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式
(2)上图装置中NaOH溶液的作用是
(3)步骤二中,水浴加热所需仪器有
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法
(5)影响产品产量的主要因素有
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是
您最近一年使用:0次
真题
7 . 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________ 。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________ L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________ 。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________ 。②吸收后氨水的物质的量浓度_______________ (答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
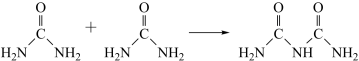 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________ 。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
 +NH3
+NH3已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比
您最近一年使用:0次
8 . 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是________ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______ g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______ g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
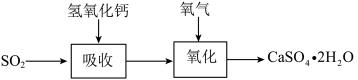
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________ 。和碱法相比,石灰-石膏法的优点是________________ ,缺点是________________ 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)________________ 。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:

碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)
您最近一年使用:0次
2019-01-30更新
|
1366次组卷
|
5卷引用:2013年全国普通高等学校招生统一考试化学(上海卷)
9 . 工业生产纯碱的工艺流程示意图如下:
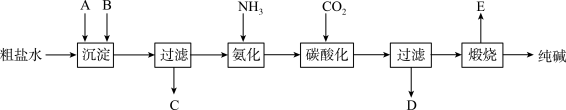
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A__________________________________ B__________________________________
(2)实验室提纯粗盐的实验操作依次为:
取样、______ 、沉淀、______ 、______ 、冷却结晶、______ 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________________________ 。
碳酸化时没有析出碳酸钠晶体,其原因是_______________________________________ 。
(4)碳酸化后过滤,滤液D最主要的成分是_____________________________ (填写化学式),检验这一成分的阴离子的具体方法是:________________________________________ 。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_________________________________________________________
滤液D加石灰水前先要加热,原因是_____________________________________________ 。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
_____________________________________________________________________________
(注明你的表达式中所用的有关符号的含义)

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A
(2)实验室提纯粗盐的实验操作依次为:
取样、
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是
碳酸化时没有析出碳酸钠晶体,其原因是
(4)碳酸化后过滤,滤液D最主要的成分是
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:
滤液D加石灰水前先要加热,原因是
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
您最近一年使用:0次
2019-01-30更新
|
2020次组卷
|
6卷引用:2010年全国普通高等学校招生统一考试上海卷化学试题
2010年全国普通高等学校招生统一考试上海卷化学试题2010年高考化学试题分项专题十五 化学实验(已下线)2011届湖北省天门市高三模拟考试(一)(理综)化学部分(已下线)2014届贵州省遵义市高三五校联考理综化学试卷贵州省余庆中学2019-2020学年上学期开学考试高三化学试题2020届高三化学大二轮增分强化练——化学工艺流程题
真题
解题方法
10 . 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500mL,所需的玻璃仪器有玻璃棒、_______________ 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是_______ ,控制溶液的pH约为8.0的目的是________ 、__________ 。
(3)试剂b是________ ,步骤Ⅳ的目的是_______________ 。
(4)步骤Ⅴ所含的操作依次是_______________ 、___________ 。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④____ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为__________________ (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是_______________ 。

完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500mL,所需的玻璃仪器有玻璃棒、
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是
(3)试剂b是
(4)步骤Ⅴ所含的操作依次是
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④
若实验操作规范而测定结果偏低,其原因是
您最近一年使用:0次



