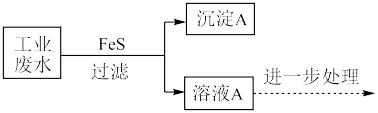
1 . 利用FeS作为沉淀剂除去某工业废水中Pb2+的部分流程如下:
(1)结合化学用语,从平衡移动角度解释可用FeS除去Pb2+的原因___________ 。
(2)可使(1)中平衡发生移动所需最小c(Pb2+)=___________ mol·L-1。(只写计算结果)
(3)处理1 L含Pb2+浓度为3.07 mg·L-1的该废水至合格(Pb2+浓度小于1 mg·L-1)最少所需FeS的质量是___________ mg。
| 溶度积(均为18~25℃数据) | |
| Ksp(FeS) | Ksp(PbS) |
| 约为10-18 | 约为10-28 |
(1)结合化学用语,从平衡移动角度解释可用FeS除去Pb2+的原因
(2)可使(1)中平衡发生移动所需最小c(Pb2+)=
(3)处理1 L含Pb2+浓度为3.07 mg·L-1的该废水至合格(Pb2+浓度小于1 mg·L-1)最少所需FeS的质量是
您最近一年使用:0次
名校
2 . 下列说法中正确的是
| A.电解氯化铜溶液就是氯化铜的电离 |
| B.电解氯化铜溶液是化学变化,不通电也能发生 |
| C.氯化铜溶液是强电解质 |
| D.电解是最强的氧化还原手段,不能自发进行的氧化还原也可以发生 |
您最近一年使用:0次
名校
3 . 下图是一个双液原电池装置图,试回答下列问题。___________ 。
(2)下列说法正确的是___________。

(2)下列说法正确的是___________。
| A.盐桥中的负离子向ZnSO4溶液中移动 | B.电子从铜片经灵敏电流计流向锌片 |
| C.锌片作电池的正极 | D.铜片质量不变 |
您最近一年使用:0次
4 . 与氮元素同主族的磷元素化合物有如下反应,其中反应物有:PH3、H2SO4、KClO3;生成物有:K2SO4、H3PO4、H2O和一种未知物质X。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是___________ ,被氧化的元素是___________ 。
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为___________ 。
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。___________
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
(5)在该反应中转移电子2mol时,生成H3PO4___________ mol。
(1)已知KClO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为
(3)完成并配平上述反应的化学方程式,标出电子转移方向和数目。
___________PH3+___________H2SO4+___________KClO3=___________K2SO4+___________H3PO4+___________H2O+___________
(4)根据上述反应可推知___________。
| A.氧化性:KClO3 > H3PO4 | B.氧化性:KClO3 > H2O |
| C.还原性:PH3 > X | D.还原性:PH3 > K2SO4 |
您最近一年使用:0次
名校
5 . 下列有关氧化还原反应的叙述,正确的是
| A.“蜡炬成灰泪始干”中“蜡炬成灰”过程中只发生了物理反应 |
| B.有单质参加或有单质生成的化学反应一定是氧化还原反应 |
| C.氧化还原反应本质上是两个半反应之间竞争电子的反应 |
| D.向CuSO4溶液中通入H2S气体,生成黑色沉淀,此过程中发生了氧化还原反应 |
您最近一年使用:0次
名校
解题方法
6 . 室温下,通过下列实验探究 溶液的性质。
溶液的性质。
(1)实验1的溶液中存在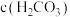
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)实验2过程中,水的电离程度___________ (填“逐渐增大”“逐渐减小”或“基本不变”)
(3)实验3反应后的溶液中,所含离子浓度大小与关系正确的是___________。
(4)从平衡移动角度解释实验4中产生气体和沉淀的原因:___________ 。
(5)若想使碳酸氢钠溶液中 的比值变小,可加入的物质是___________。
的比值变小,可加入的物质是___________。
 溶液的性质。
溶液的性质。| 实验1 | 用pH试纸测得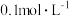  溶液的pH约为8 溶液的pH约为8 |
| 实验2 | 向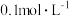  溶液中加入等体积 溶液中加入等体积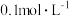 盐酸 盐酸 |
| 实验3 | 向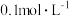  溶液中加入等体积 溶液中加入等体积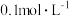 NaOH溶液 NaOH溶液 |
| 实验4 | 向浓 溶液中加入浓 溶液中加入浓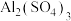 溶液,有气体和沉淀生成 溶液,有气体和沉淀生成 |
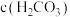
 (填“>”“<”或“=”)
(填“>”“<”或“=”)(2)实验2过程中,水的电离程度
(3)实验3反应后的溶液中,所含离子浓度大小与关系正确的是___________。
A. |
B. |
C. |
D.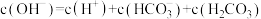 |
(5)若想使碳酸氢钠溶液中
 的比值变小,可加入的物质是___________。
的比值变小,可加入的物质是___________。| A.通入HCl | B.NaOH固体 | C.通入CO2 | D. 固体 固体 |
您最近一年使用:0次
7 . 下列应用与盐类水解无关的是
| A.泡沫灭火器 | B.草木灰不宜与铵态氮肥混合使用 |
| C.纯碱去油污 | D.漂粉精杀菌消毒 |
您最近一年使用:0次
名校
8 . 现有4.1g含杂质的烧碱样品,某小组同学为测定其纯度,将其配制成250mL待测液,准确量取10.00mL待测液,并用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液(假设烧碱中不含有与酸反应的杂质),试根据实验回答。
(1)在上述溶液配制与滴定过程中,不需要用到的实验仪器是___________。
(2)选用___________ 为指示剂,滴定终点的判断依据是___________ 。
(3)根据表中数据,计算样品烧碱的质量分数为___________ (结果保留两位有效数字)。
(4)滴定过程,下列情况会使测定结果偏高的是___________。
(1)在上述溶液配制与滴定过程中,不需要用到的实验仪器是___________。
A. | B. | C. | D. |
(3)根据表中数据,计算样品烧碱的质量分数为
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| A.量取待测液的滴定管水洗后,直接用来量取待测液 |
| B.滴定前,滴定管有气泡,滴定后消失 |
| C.滴定过程中振荡锥形瓶时不慎有少量液体溅出 |
| D.盛装待测液的锥形瓶水洗后未烘干 |
您最近一年使用:0次
名校
解题方法
9 . 平衡思想是化学研究的一个重要观念,在电解质溶液中存在电离平衡、水解平衡、溶解平衡等多种平衡。
I.25℃时,三种弱酸的电离平衡常数如下:
回答下列问题:
(1)碳酸二级电离平衡常数的表达式为Ka2=___________ 。
(2)下列四种离子结合质子能力由大到小的顺序是___________ 。
A.CO B.ClO- C.CH3COO- D.HCO
B.ClO- C.CH3COO- D.HCO
(3)下列反应不能发生的是___________。
Ⅱ.体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如下图所示。___________ mol·L-1。
(5)用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸___________HX。
I.25℃时,三种弱酸的电离平衡常数如下:
| 弱酸 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | Ka1=4.2×10-7,Ka2=4.8×10-11 | 3.0×10-8 |
(1)碳酸二级电离平衡常数的表达式为Ka2=
(2)下列四种离子结合质子能力由大到小的顺序是
A.CO
 B.ClO- C.CH3COO- D.HCO
B.ClO- C.CH3COO- D.HCO
(3)下列反应不能发生的是___________。
A.CO +2CH3COOH=2CH3COO-+CO2↑+H2O +2CH3COOH=2CH3COO-+CO2↑+H2O |
| B.ClO-+CH3COOH=CH3COO-+HClO |
C.CO +2HClO=CO2↑+H2O+2ClO- +2HClO=CO2↑+H2O+2ClO- |
D.2ClO-+CO2+H2O=CO +2HClO +2HClO |
Ⅱ.体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如下图所示。
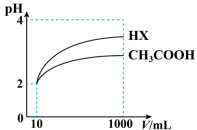
(5)用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸___________HX。
| A.大于 | B.等于 | C.小于 | D.无法比较 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
| A.pH<7的溶液不一定是酸溶液 |
B.常温下,pH=5的溶液和pH=3的溶液相比,后者 是前者的100倍 是前者的100倍 |
C.室温下,每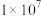 个水分子中只有一个水分子发生电离 个水分子中只有一个水分子发生电离 |
D.在 的氨水中,改变外界条件使 的氨水中,改变外界条件使 增大,则溶液pH一定减小 增大,则溶液pH一定减小 |
您最近一年使用:0次



