I.碳酸钠的制备
制备流程如图所示。

(1)滤渣的成分有
(2)写出灼烧碳酸氢钠的化学方程式
(3)根据相关物质的溶解度随温度的变化曲线(如图所示),制备NaHCO3时反应温度控制在30~35℃之间,温度过高或者过低都不利于反应进行,原因是

II.碳酸钠含量分析
称取制备的碳酸钠2.00g,配制成250mL溶液,取25.00mL于锥形瓶中,加入2滴某指示剂,用0.1000mol/L盐酸滴定至第一滴定终点,消耗16.00mL盐酸。再加入2滴甲基橙,继续滴加盐酸,溶液由黄色变为橙色后,加热煮沸1~2min,冷却后溶液又变为黄色,继续用盐酸滴定,溶液重新变为橙色,直至加热不褪色即为第二滴定终点,最终共消耗34.00mL盐酸。
(5)第一滴定终点的现象为
(6)滴定过程中加热煮沸溶液的目的是
(7)产品中Na2CO3的质量分数为

已知A中反应的化学方程式:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。完成下列填空:
(1)C装置中覆盖食用油的目的是
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||
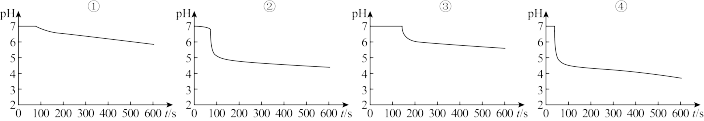
(2)曲线①呈缓慢下降趋势,这是因为
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
3 . 铜(Ⅱ)氨基酸配合物是合成重要生物聚合物的单体,甘氨酸( ,简写为
,简写为 )在约70℃条件下,可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应方程式如下:
)在约70℃条件下,可与氢氧化铜反应制备二甘氨酸合铜(Ⅱ)水合物,其反应方程式如下:
回答下列问题:
Ⅰ.氢氧化铜的制备
①将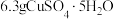 和
和 水加入烧杯中。
水加入烧杯中。
②完全溶解后,搅拌下加入氨水至沉淀完全溶解。
③加入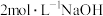 溶液至不再生成沉淀,过滤,用水洗涤。
溶液至不再生成沉淀,过滤,用水洗涤。
(1)步骤②中沉淀溶解过程中反应的离子方程式为
(2)步骤③中检验沉淀洗涤干净的操作为
Ⅱ.二甘氨酸合铜水合物的制备
④称取 甘氨酸,溶于
甘氨酸,溶于 水中。
水中。
⑤在65~70℃条件下加热,搅拌下加入新制的 ,至
,至 全部溶解。
全部溶解。
⑥热抽滤,向滤液加入中 无水乙醇。
无水乙醇。
⑦抽滤,用乙醇溶液洗涤晶体,再用丙酮洗涤,抽干。
⑧将产品烘干,称重得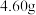 产品。
产品。
(3)步骤(4)中使用的部分仪器如下。仪器
 的名称是
的名称是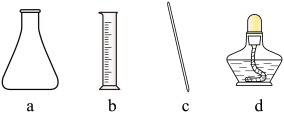
(4)甘氨酸易溶于水,难溶于乙醇。试从物质结构的角度分析其易溶于水的原因
(5)步骤⑥中需要对反应液进行热抽滤的原因为
Ⅲ.产品中铜含量的测定
称取 样品,加入水和稀
样品,加入水和稀 溶解,配制成
溶解,配制成 溶液。取
溶液。取 该溶液,加入足量固体
该溶液,加入足量固体 和
和 水,以淀粉为指示剂,立即用
水,以淀粉为指示剂,立即用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液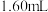 。
。
已知:在酸性介质中,配合物中的gly被质子化,配合物被破坏; ,
, 。
。
(6)滴定终点溶液颜色的变化
(7)产品中铜元素的质量分数为
4 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:
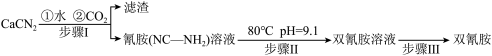
已知氰胺二聚反应机理为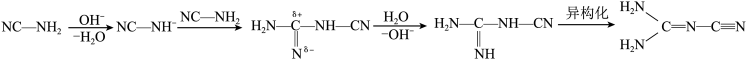
(1)已知:氰基是吸电子基团。氰氨
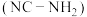 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
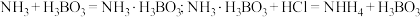

②仪器清洗后,g中加入硼酸
 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭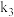 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。
,加热b,使水蒸气进入e。d中保留少量水的目的是
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为 反应原理:
反应原理:①缩合反应

③酸化反应

实验步骤:
①向三颈烧瓶中加入
 丙酮、少量
丙酮、少量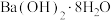 ,加热至丙酮出现回流时,在加热搅拌下缓慢滴入
,加热至丙酮出现回流时,在加热搅拌下缓慢滴入 巴豆醛。控制温度约为70℃、回流2.5h后停止反应,过滤、蒸馏得到巴豆烯叉丙酮。
巴豆醛。控制温度约为70℃、回流2.5h后停止反应,过滤、蒸馏得到巴豆烯叉丙酮。②在室温下,将
 溶液、20%
溶液、20% 溶液依次滴加到巴豆烯叉丙酮中,并不断搅拌直至有机相液体体积不再增大,停止搅拌,将混合液转入分液漏斗中,静置、分离得到山梨酸钠水溶液,再用
溶液依次滴加到巴豆烯叉丙酮中,并不断搅拌直至有机相液体体积不再增大,停止搅拌,将混合液转入分液漏斗中,静置、分离得到山梨酸钠水溶液,再用 处理水溶液中过量的
处理水溶液中过量的 。
。③将质量分数为30%的稀
 缓慢滴入山梨酸钠水溶液中,并不断搅拌至溶液
缓慢滴入山梨酸钠水溶液中,并不断搅拌至溶液 ,过滤、洗涤得山梨酸粗产品。
,过滤、洗涤得山梨酸粗产品。④将适量蒸馏水加入粗产品中,加热溶解,冷却结晶,减压过滤,干燥后得到
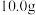 山梨酸。已知:
山梨酸。已知:①山梨酸微溶于水,易溶于有机溶剂。易被强氧化剂HClO等氧化;
②部分有机物密度为:巴豆醛
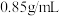 ,氯仿
,氯仿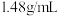 ,丙酮
,丙酮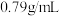 。
。回答下列问题:
(1)步骤①分离出巴豆烯叉丙酮的装置如图1所示(加热及夹持装置省略),虚线框内连接的仪器为

(3)用
 处理过量的
处理过量的 时反应的离子方程式为
时反应的离子方程式为 除去过量的
除去过量的 ,原因是
,原因是(4)步骤③中,检测洗涤是否完成的操作是
(5)本实验中山梨酸的产率为
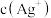 保持定值时,电解池不工作。待测物质进入电解池后与
保持定值时,电解池不工作。待测物质进入电解池后与 反应,测氯仪便立即自动进行电解到
反应,测氯仪便立即自动进行电解到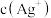 ,又回到原定值,测定结束。下列说法错误的是
,又回到原定值,测定结束。下列说法错误的是
A.电解池中的阳极反应是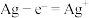 |
B.处理后的食用油样品氯转化为HCl,通入测氯仪中发生反应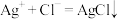 |
C.样品中存在的 会导致测定结果偏大,用碘水处理样品可以消除误差 会导致测定结果偏大,用碘水处理样品可以消除误差 |
D.样品为ag,电解消耗的电量为x库仑,样品中氯的含量(按含氯元素计)为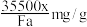 (已知:电解中转移1mol电子所消耗的电量为F库仑) (已知:电解中转移1mol电子所消耗的电量为F库仑) |
 、
、 含量是当今世界重要科研课题之一,以
含量是当今世界重要科研课题之一,以 、
、 为原料制备乙醇、甲醇、甲酸等能源物质具有较好的发展前景。问答下列问题:
为原料制备乙醇、甲醇、甲酸等能源物质具有较好的发展前景。问答下列问题:(1)在催化剂作用下,二氧化碳加氢可合成乙醇:
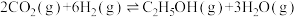 。保持压强为5MPa,向恒压密闭容器中通入一定量
。保持压强为5MPa,向恒压密闭容器中通入一定量 和
和 发生上述反应,
发生上述反应, 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 [
[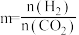 ]的关系如图所示。
]的关系如图所示。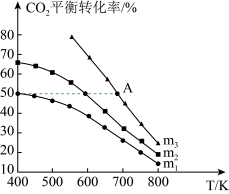
 、
、 、
、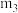 由小到大的顺序为
由小到大的顺序为②若
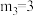 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数 的数值为
的数值为 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。③若实验容器改为在绝热的密闭容器中进行,实验测得
 的转化率随时间变化的示意图如图所示,b点
的转化率随时间变化的示意图如图所示,b点
 (填“<”、“=”或“>”),
(填“<”、“=”或“>”),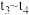 时刻,
时刻, 的转化率降低的原因是
的转化率降低的原因是
 ,试分析该法提高甲烷转化为甲醇的转化效率的原因:
,试分析该法提高甲烷转化为甲醇的转化效率的原因:(3)我国科学家已经成功地利用二氧化碳催化氢化获得甲酸,利用化合物1催化氢化二氧化碳的反应过程如图甲所示,其中化合物2与
 反应变成化合物3与
反应变成化合物3与 的反应历程如图乙所示,其中TS表示过渡态,I表示中间体。回答下列问题:
的反应历程如图乙所示,其中TS表示过渡态,I表示中间体。回答下列问题:
②从平衡移动的角度看,
 反应变成化合物3与
反应变成化合物3与 。
。(4)采用“
 催化加氢制甲醇”方法将其资源化利用。下图是用甲醇燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为
催化加氢制甲醇”方法将其资源化利用。下图是用甲醇燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为
| A.舞蹈《瓷影》所诠释的青花瓷,其主要原材料为含水的铝硅酸盐 |
| B.晚会采用的LED屏,其发光材料通常是以Si3N4为基础,用Al取代部分Si,用O取代部分N后所得的陶瓷制作而成 |
| C.5G-A技术所需高频通讯材料之一的LCP(液晶高分子)在一定加热状态下一般会变成液晶,液晶既具有液体的流动性,又表现出类似晶体的各向异性 |
| D.芯片中二氧化硅优异的半导体性能。使得晚会上各种AI技术得以完美体现 |
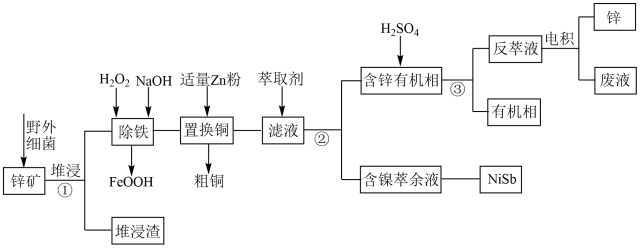
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH较高时,氢氧化氧铁为胶状沉淀;③在我国,富矿少、贫矿多,品位低于5%的矿山属于贫矿。回答下列问题:
(1)“堆浸渣”的主要成分为
A.将锌矿粉碎 B.大幅度升温 C.延长堆浸时间 D.将锌矿充分暴露
(2)“除铁”时Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀而除去,但是有Fe3+存在时,pH升高,Zn2+、Cu2+、Ni2+的去除率均升高,原因可能为
(3)“置换铜”时用锌粉直接置换镍的速率极小,目前采用“锑盐净化法”,即在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为
(4)“萃取”时需要进行多次萃取且合并萃取液,其目的是
(5)反萃液的主要成分为ZnSO4,可通过一系列反应制备对可见光敏感的半导体催化剂ZnFe2O4。其中在无氧条件下灼烧ZnFe2(C2O4)3·6H2O获得产品ZnFe2O4时发生反应的化学方程式为
(6)“电积”时在
 )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示: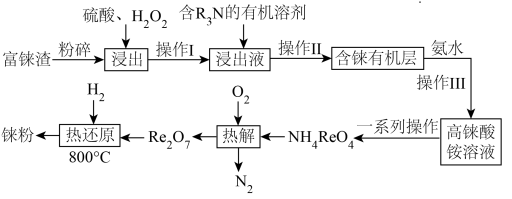
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
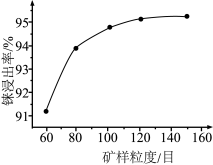
| A.60 | B.80 | C.100 | D.120 |
(2)已知“浸出”时反应中
 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
A.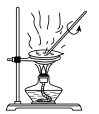 | B.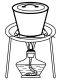 | C.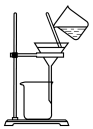 | D. |
(4)“一系列操作”包括①
A. B.
B. C.
C. D.
D.
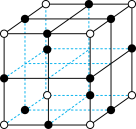
(6)
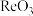 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为