1 . 双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。某学习小组设计一组与双氧水相关的实验如表所示:
请回答下列问题:
(1)实验Ⅰ的离子方程式为_____________________________ ;该原理广泛用于除去Fe3+中的Fe2+的操作中,此操作的优点是__________ 。
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是________ ,反应的离子方程式为_________________________ 。当有1.7g过氧化氢参加反应时转移的电子数目为_____________ 。
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是________ (填选项字母)。
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式________________________________________ 。
| 实验 | 实验操作与现象 |
| Ⅰ | 向含少量硫酸亚铁的硫酸铁溶液中滴加双氧水和稀硫酸 |
| Ⅱ | 向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去 |
| Ⅲ | 向淀粉-KI溶液中滴加双氧水,溶液变蓝色 |
| Ⅳ | 向双氧水加入铁红粉末,产生大量气泡 |
请回答下列问题:
(1)实验Ⅰ的离子方程式为
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式
您最近一年使用:0次
2020高三·全国·专题练习
2 . IBr、ICl、BrF3等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称为拟卤素,它们的化学性质均与卤素单质相似,请回答下列问题。
(1)氯化碘(ICl)中碘元素的化合价为________ ;它与水反应的化学方程式为ICl+H2O=HIO+HCl,该反应的反应类型为________ (填中学常见的无机反应类型)。
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,发生反应的离子方程式为__________________ 。
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象:________________________ 。
②下列物质中,也可以使该溶液红色褪去的是________ (填字母)。
A.新制氯水 B.碘水
C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法:在碱性条件下用NaClO溶液将CN-氧化为CO32-和一种单质气体,该反应的离子方程式为_____________________ 。
(5)已知HCN的电离常数K=6.2×10-10,H2CO3的电离常数K1=4.5×10-7,K2=4.7×10-11,则下列离子方程式能发生的是________ (填字母)。
A.CN-+CO2+H2O=HCN+
B.2HCN+ =2CN-+CO2↑+H2O
=2CN-+CO2↑+H2O
C.2CN-+CO2+H2O=2HCN+
D.HCN+ =CN-+
=CN-+
(1)氯化碘(ICl)中碘元素的化合价为
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,发生反应的离子方程式为
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象:
②下列物质中,也可以使该溶液红色褪去的是
A.新制氯水 B.碘水
C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法:在碱性条件下用NaClO溶液将CN-氧化为CO32-和一种单质气体,该反应的离子方程式为
(5)已知HCN的电离常数K=6.2×10-10,H2CO3的电离常数K1=4.5×10-7,K2=4.7×10-11,则下列离子方程式能发生的是
A.CN-+CO2+H2O=HCN+

B.2HCN+
 =2CN-+CO2↑+H2O
=2CN-+CO2↑+H2OC.2CN-+CO2+H2O=2HCN+

D.HCN+
 =CN-+
=CN-+
您最近一年使用:0次
3 . IBr、ICl等称之为卤素互化物,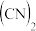 、
、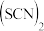 、
、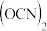 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
 氯化碘
氯化碘 能与水发生反应:
能与水发生反应: ,该反应
,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应。
氧化还原反应。
 溴化碘
溴化碘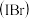 具有强氧化性,能与
具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为___ 。
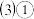 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性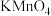 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________ 。
 下列物质中,也可以使该溶液红色褪去的是
下列物质中,也可以使该溶液红色褪去的是 _________ 。
A.新制氯水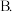 碘水
碘水 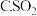
 盐酸
盐酸
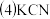 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将 氧化为
氧化为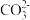 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为_______________ 。
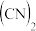 、
、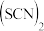 、
、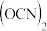 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。 氯化碘
氯化碘 能与水发生反应:
能与水发生反应: ,该反应
,该反应 填“是”或“不是”
填“是”或“不是” 氧化还原反应。
氧化还原反应。 溴化碘
溴化碘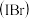 具有强氧化性,能与
具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性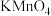 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象 下列物质中,也可以使该溶液红色褪去的是
下列物质中,也可以使该溶液红色褪去的是 A.新制氯水
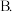 碘水
碘水 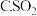
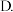 盐酸
盐酸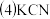 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将 氧化为
氧化为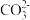 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为
您最近一年使用:0次
2020-01-30更新
|
274次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——氯及其化合物
4 . 三氧化砷,俗称砒霜,分子式As2O3,是最具商业价值的砷化合物及主要的砷化学开始物料。它也是最古老的毒物之一,无臭无味,外观为白色霜状粉末,故称砒霜。
(1)完成并配平下列化学方程式:___ As2O3+___ Zn+___ H2SO4→___ AsH3+___ ZnSO4+___
(2)As2O3在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为___ mol。
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式___ 。
(1)完成并配平下列化学方程式:
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式
您最近一年使用:0次
2020-03-21更新
|
338次组卷
|
4卷引用:专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)2015届陕西省渭南市高三教学质量检测(一模)化学试卷上海市六校联考2015-2016学年高三上学期期中考试化学试题沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题
2024高三下·全国·专题练习
5 . 某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。_______ 。(包括使用时段与内容)。
(2)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是 ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
请设计一个简单的实验证明甲同学的看法是否正确:_______ 。
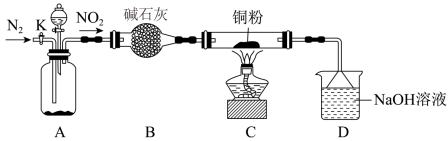
(2)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是
 ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:| 稀硫酸 | 氨水 | |
| Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
| CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
| Cu | --- | --- |
您最近一年使用:0次
6 . 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是________ ,只有负价而无正价的是________ ,氧化性最强的单质是_______ ,还原性最强的单质是________ 。
(2)最高价氧化物的水化物中碱性最强的是________ ,酸性最强的是________ ,呈两性的是________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物中碱性最强的是
您最近一年使用:0次
解题方法
7 . 研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于__________ 氧化物(填“酸性”“碱性”或“两性”)。盛装NaOH 等碱性溶液的试剂瓶不能用玻璃塞,其原因可用离子方程式表示为____________________________ 。
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
①据SiO2中Si元素的价态可推知SiO2_____________ (填字母):
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
②工业上用石英砂和焦炭混合高温制取粗硅,其反应为:SiO2+2C Si+2CO↑
Si+2CO↑
用双线桥法标出电子转移方向与数目:____________________________ 。
(3)从其它角度认识可能具有的特性。
SiO2能与唯一的酸____________ (填物质名称或化学式)反应,工艺上常利用该反应___________ (填一种用途)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
①据SiO2中Si元素的价态可推知SiO2
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
②工业上用石英砂和焦炭混合高温制取粗硅,其反应为:SiO2+2C
 Si+2CO↑
Si+2CO↑用双线桥法标出电子转移方向与数目:
(3)从其它角度认识可能具有的特性。
SiO2能与唯一的酸
您最近一年使用:0次
名校
8 . 已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________ 。
(2)As2O3在上述反应中显示出来的性质是____________ (填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________ ,还原产物是________ 。
(4)若生成0.2 mol AsH3,则转移的电子数为___________ 。
 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。(1)请用双线桥法标出电子转移的方向和数目
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是
(4)若生成0.2 mol AsH3,则转移的电子数为
您最近一年使用:0次
2017-11-27更新
|
2991次组卷
|
13卷引用:2018年高一化学(人教版)必修1综合题型练习卷:氧化还原反应
2018年高一化学(人教版)必修1综合题型练习卷:氧化还原反应(已下线)2019年10月2日《每日一题》必修1—— 氧化还原反应电子转移方向和数目的表示(已下线)易错专题07 氧化还原反应电子转移的表示及方程式的书写-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)2014-2015学年湖南省益阳市箴言中学高一12月月考化学试卷(已下线)2.3.1 氧化还原反应高中化学人教版 必修1 第二章 化学物质及其变化 3.氧化还原反应 氧化还原反应人教版高中化学必修一 第二章化学物质及其变化 单元测试题河南省安阳市第二中学2018-2019学年高一上学期期中考试化学试题【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高一上学期期末联考化学试题(已下线)第二章 化学物质及其变化(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)2.3.1 氧化还原反应(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)新疆维吾尔自治区喀什第二中学2020-2021学年高一上学期期末考试化学试题广东省南阳中学、清新一中、佛冈一中、连州中学、连 山中学五校2022-2023学年高一上学期12月联考化学试题
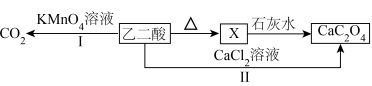
9 . 乙二酸(俗称草酸)是最简单的二元羧酸。下图流程表示其部分转化关系。[已知: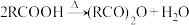 ]
]
(1)草酸是一种重要的还原剂,在分析化学上常被用作测定高锰酸钾溶液浓度的试剂。写出途径Ⅰ反应的离子方程式_____ 。
(2)①X是具有六元环状结构的碳氧化合物,C、O原子均满足8电子结构。写出X的结构式_____ 。
②下列说法正确的是_____ 。
A.X是一种酸性氧化物B.由途径Ⅱ可知,草酸钙不溶于稀盐酸
C.乙二酸的酸性比乙酸强D.乙二酸跟足量乙醇反应生成乙二酸乙二酯
③乙二酸易溶于乙醇,难溶于苯和氯仿,原因是_____ 。
(3)设计实验验证气态化合物X既有氧化性又有还原性_____ 。
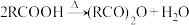 ]
]
(1)草酸是一种重要的还原剂,在分析化学上常被用作测定高锰酸钾溶液浓度的试剂。写出途径Ⅰ反应的离子方程式
(2)①X是具有六元环状结构的碳氧化合物,C、O原子均满足8电子结构。写出X的结构式
②下列说法正确的是
A.X是一种酸性氧化物B.由途径Ⅱ可知,草酸钙不溶于稀盐酸
C.乙二酸的酸性比乙酸强D.乙二酸跟足量乙醇反应生成乙二酸乙二酯
③乙二酸易溶于乙醇,难溶于苯和氯仿,原因是
(3)设计实验验证气态化合物X既有氧化性又有还原性
您最近一年使用:0次
名校
10 . 亚硝酸钠既有氧化性也有还原性,易溶于水,水溶液显碱性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放,处理方法之一如下:NaNO2 +KI+_____ NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
(1)配平上述化学方程式,请写出其完整方程式___________ 。
(2)鉴于NO是有毒气体,从环保角度来讲,要处理NaNO2,可以选用以下试剂___________
A. FeCl2 B. H2O2 C. KMnO4 D. H2SO4
(3)根据信息,鉴别亚硝酸钠和氯化钠的简单方法是___________ 。
(4)已知亚硝酸钠与氯化铵反应生成氮气、氯化钠和水,写出该反应的化学方程式并用双线桥表示其电子转移的方向和数目:___________ 。
 NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:
NO↑+I2+K2SO4+Na2SO4+___________。请回答下列问题:(1)配平上述化学方程式,请写出其完整方程式
(2)鉴于NO是有毒气体,从环保角度来讲,要处理NaNO2,可以选用以下试剂
A. FeCl2 B. H2O2 C. KMnO4 D. H2SO4
(3)根据信息,鉴别亚硝酸钠和氯化钠的简单方法是
(4)已知亚硝酸钠与氯化铵反应生成氮气、氯化钠和水,写出该反应的化学方程式并用双线桥表示其电子转移的方向和数目:
您最近一年使用:0次



