解题方法
1 . I.水中溶解氧气的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,反应方程式为2S2O +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 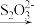 S4O
S4O 。
。
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________ 。
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为_________ mg·L-1。
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为________ mol/L(保留一位小数),需用量筒量取30%的双氧水_________ mL。
(2)该实验在酸性条件下进行,则实验设计的反应原理是_____________ (用离子方程式表示)。
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为_________ (用含a、b的式子表示)。
 +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 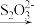 S4O
S4O 。
。(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为
(2)该实验在酸性条件下进行,则实验设计的反应原理是
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为
您最近一年使用:0次
名校
2 . Ⅰ.目前合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
___C+ K2Cr2O7+___H2SO4===___CO2↑+___Cr2(SO4)3+___K2SO4+___H2O
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)_____________ 。
(2)该反应的氧化剂是______________ ,氧化产物的电子式为__________________ 。
(3)H2SO4在上述反应中表现出来的性质是________ (填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2 mol CO2 ,则转移电子的物质的量是_________ mol。
Ⅱ.三氟化氮(NF3)是一种无色无味的气体,可由氟与氨在一定条件下反应制得。
(1)写出该反应化学方程式并标明电子转移的方向和数目____________________________ 。
(2)27.0 mL NF3和水充分反应,生成 18.0 mL NO(同温、同压下),写出反应的化学方程式:______________________________________________________________________ 。
(3)NF3是一种无色无味的气体,但一旦NF3在空气中泄漏,还是易于发现的。该气体泄漏时的现象是_________________________________________________________________ 。
___C+ K2Cr2O7+___H2SO4===___CO2↑+___Cr2(SO4)3+___K2SO4+___H2O
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)
(2)该反应的氧化剂是
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2 mol CO2 ,则转移电子的物质的量是
Ⅱ.三氟化氮(NF3)是一种无色无味的气体,可由氟与氨在一定条件下反应制得。
(1)写出该反应化学方程式并标明电子转移的方向和数目
(2)27.0 mL NF3和水充分反应,生成 18.0 mL NO(同温、同压下),写出反应的化学方程式:
(3)NF3是一种无色无味的气体,但一旦NF3在空气中泄漏,还是易于发现的。该气体泄漏时的现象是
您最近一年使用:0次
3 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:第一步反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,第二步,将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2.现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为_______ mol。
(2)至少需要NaClO3的物质的量为_______ mol。
(3)通过两步制备共产生ClO2质量为_______ 克。
(1)通入的HCl气体物质的量为
(2)至少需要NaClO3的物质的量为
(3)通过两步制备共产生ClO2质量为
您最近一年使用:0次
2022高三·全国·专题练习
4 . 现有m g某气体(双原子分子),其摩尔质量为M g·mol-1,若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为___________ mol。
(2)该气体所含原子总数为___________ 。
(3)该气体在标准状况下的体积为___________ L。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体在标准状况下的体积为
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2
 2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
2O3,将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2023高三·全国·专题练习
5 . 已知:常温下,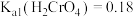 ,
,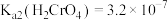 。试推测常温下,
。试推测常温下,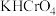 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”),其原因是_______ (用必要的文字说明)。
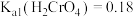 ,
,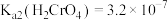 。试推测常温下,
。试推测常温下,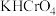 溶液呈
溶液呈
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
6 . 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)氯铂酸钡(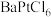 )固体加热时部分分解为
)固体加热时部分分解为 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数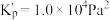 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量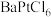 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为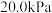 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为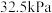 ,则
,则
_______  ,反应
,反应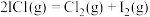 的平衡常数K=
的平衡常数K=_______ (列出计算式即可)。
(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数 。
。
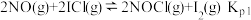

得到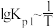 和
和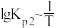 均为线性关系,如下图所示:
均为线性关系,如下图所示:
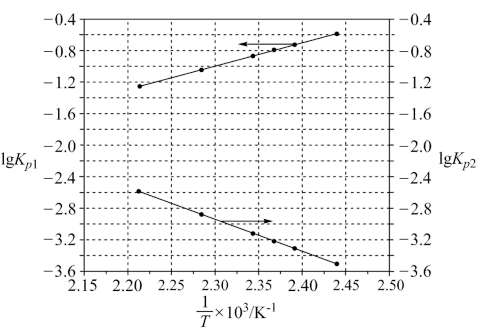
反应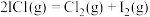 的K=
的K=_______ (用 、
、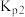 表示)。
表示)。
(1)氯铂酸钡(
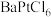 )固体加热时部分分解为
)固体加热时部分分解为 、
、 和
和 ,376.8℃时平衡常数
,376.8℃时平衡常数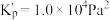 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量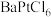 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为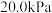 。376.8℃平衡时,测得烧瓶中压强为
。376.8℃平衡时,测得烧瓶中压强为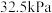 ,则
,则
 ,反应
,反应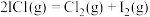 的平衡常数K=
的平衡常数K=(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数
 。
。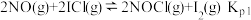

得到
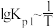 和
和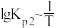 均为线性关系,如下图所示:
均为线性关系,如下图所示:
反应
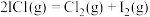 的K=
的K= 、
、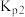 表示)。
表示)。
您最近一年使用:0次
解题方法
7 . (1)加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是_______ 。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________ 。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中 含氧气8 g/L的溶解氧,需要肼的质量为
含氧气8 g/L的溶解氧,需要肼的质量为__________ 。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中
 含氧气8 g/L的溶解氧,需要肼的质量为
含氧气8 g/L的溶解氧,需要肼的质量为
您最近一年使用:0次
解题方法
8 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:2NaClO3+4HCl=2ClO2↑+C12↑+2NaCl+2H2O。现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为___ 。
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克___ (写出计算步骤)?
(1)通入的HCl气体物质的量为
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克
您最近一年使用:0次
2021高三·全国·专题练习
9 . 十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。已知:
2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-196.6kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0kJ·mol-1
则NO2氧化SO2的热化学方程式为_______ 。
2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-196.6kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0kJ·mol-1
则NO2氧化SO2的热化学方程式为
您最近一年使用:0次
2020高三·全国·专题练习
10 . (1) 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由下表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为_______ ,生成硫酸铜的物质的量为________ 。
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2 MnO(OH)2
MnO(OH)2 I2
I2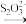 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程________ 。
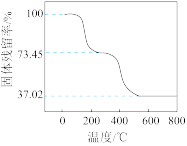
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率( )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=________ 。(写出计算过程)
| 硫 | 氢 | Y | |
| X | 硫 | Z |
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2
 MnO(OH)2
MnO(OH)2 I2
I2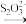 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(
 )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=
您最近一年使用:0次



