2023高三·全国·专题练习
1 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。TiO2转化为TiCl4有直接氯化法和碳氯化法
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=172kJ·mol-1
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51kJ·mol-1
在1.0×105pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

反应C(s)+CO2(g)=2CO(g)的平衡常数 Kp(1400℃)=___________ Pa。
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=172kJ·mol-1
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH2=-51kJ·mol-1
在1.0×105pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

反应C(s)+CO2(g)=2CO(g)的平衡常数 Kp(1400℃)=
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
2 . 砷(As)是第四周期VA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)⇌
(aq)+I2(aq)+2OH−(aq)⇌ (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。
 (aq)+I2(aq)+2OH−(aq)⇌
(aq)+I2(aq)+2OH−(aq)⇌ (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近一年使用:0次
2022高三·全国·专题练习
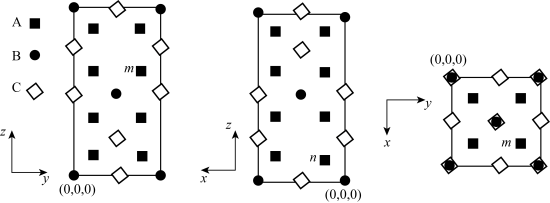
3 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为_______ ,距离Hg最近的Ag有_______ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为_______ g•cm-3(用代数式表示)。
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
2021高三·全国·专题练习
4 . 公元前,人们曾用硼砂制造玻璃和焊接黄金。现如今硼及其化合物在新材料、功能生产等方面用途依然很广。请回答下列问题:
六方氮化硼( )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为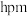 ,该晶体的密度计算式为
,该晶体的密度计算式为___________  (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
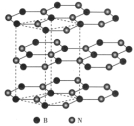
六方氮化硼(
 )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为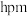 ,该晶体的密度计算式为
,该晶体的密度计算式为 (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
您最近一年使用:0次
2021高三·山东·专题练习
解题方法
5 . 甲醇用途广泛,是基础的有机化工原料和优质燃料。由 制备甲醇的过程可能涉及如下两个反应。
制备甲醇的过程可能涉及如下两个反应。
反应I: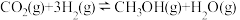 ΔH1
ΔH1
反应II: ΔH2
ΔH2
已知有关化学键键能数据如表,由此计算ΔH1_______  。
。
 制备甲醇的过程可能涉及如下两个反应。
制备甲醇的过程可能涉及如下两个反应。反应I:
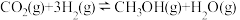 ΔH1
ΔH1反应II:
 ΔH2
ΔH2已知有关化学键键能数据如表,由此计算ΔH1
 。
。| 化学键 |  |  |  |  |  |
键能/( ) ) | 810 | 343 | 413 | 465 | 436 |
您最近一年使用:0次
2021高三·全国·专题练习
6 . 生产生活中氨及铵盐有重要用途,而汽车尾气中含NO、NO2则应降低其排放。在20℃时,已知:
①N2(g)+O2(g)=2NO(g),正、逆反应活化能分别为akJ/mol、bkJ/mol;
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;
则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为_______ 。
①N2(g)+O2(g)=2NO(g),正、逆反应活化能分别为akJ/mol、bkJ/mol;
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;
则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为
您最近一年使用:0次
2021高三·山东·专题练习
解题方法
7 . 许多元素及它们的化合物在科学研究和工业生产中具有许多用途。
(1)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为_____ ,有_____ %的正八面体空隙没有填充阳离子。
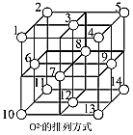
(2)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。
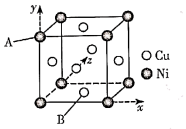
①原子B的坐标参数为____ ;
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为____ 。
(1)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为

(2)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为
您最近一年使用:0次
2018高一上·全国·专题练习
8 . 二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________ L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________ mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。__________
 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2
 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)。
您最近一年使用:0次
9 . 二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________ L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________ mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____ 。
 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2
 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)
您最近一年使用:0次
2016-04-12更新
|
755次组卷
|
2卷引用:2018年高一化学(人教版)必修1综合题型练习卷:化学计量在实验中的应用



