解题方法
1 . 金属钛用途广泛。从海水中提取Mg和 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和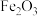 、
、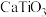 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸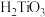 ,
,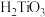 可写作
可写作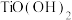 。
。
(1)试剂①通常选煅烧的贝壳粉而不用 的原因是
的原因是_____ 。
(2)试剂②为_____ 。
(3)“沉降分离”出的滤渣成分有_____ 。
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为_____ 、_____ ,过滤、洗涤、干燥。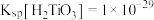 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于_____ 。
(6)反应①除生成 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为_____ ,“高温氯化”反应理论计算结果显示,在200℃条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是_____ (写一种)。
(7)该工艺流程中可以循环使用的物质有_____ 。
 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和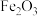 、
、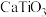 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: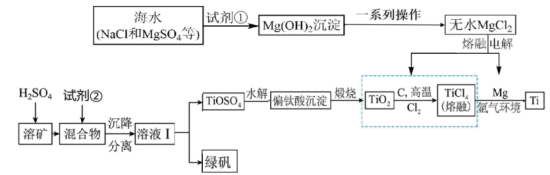
 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸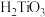 ,
,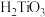 可写作
可写作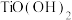 。
。(1)试剂①通常选煅烧的贝壳粉而不用
 的原因是
的原因是(2)试剂②为
(3)“沉降分离”出的滤渣成分有
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为
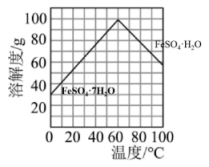
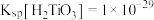 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于(6)反应①除生成
 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是(7)该工艺流程中可以循环使用的物质有
您最近一年使用:0次
2012·上海奉贤·三模
解题方法
2 . 氨气、氯气和化合物A是常见化合物,在工农业生产中有重要的应用。根据题意回答下列问题:
(1)化合物A的相对分子质量为60(含四种元素),A在一定条件下水解有氨气产生,A分子中碳元素、氧元素和氢元素的质量百分含量分别是20%、26.674%和6.7%。计算确定A的结构简式为_______ 。说出A在一种用途___________ 。
(2)NH3和Cl2在常温下可快速反应生成氮气和氯化铵:8NH3+3Cl2 →N2+6NH4Cl。该反应可用于检验化工生产中氯气是否泄漏。若要在实验室配制体积比为336:1的氨水1kg,计算此氨水的物质的量的浓度为多少________ ?(已知氨水密度为0.92g·cm-3、水的密度为0.899g·cm-3)
(3)常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体总物质的量保持不变。求:
① 反应前氯气和氨气的物质的量之比为多少________ ?
② 反应后生成的氧化产物的质量为多少________ ?
(4)已知氨气和氯气混合可发生下列反应: 2NH3+3Cl2 → 6HCl+N2,NH3+HCl → NH4Cl 现有Cl2和NH3共aL,混合后充分反应,气体体积变为bL,问有多少升的NH3被氧化________ ?(气体前后气体体积均在同温同压下)。
(1)化合物A的相对分子质量为60(含四种元素),A在一定条件下水解有氨气产生,A分子中碳元素、氧元素和氢元素的质量百分含量分别是20%、26.674%和6.7%。计算确定A的结构简式为
(2)NH3和Cl2在常温下可快速反应生成氮气和氯化铵:8NH3+3Cl2 →N2+6NH4Cl。该反应可用于检验化工生产中氯气是否泄漏。若要在实验室配制体积比为336:1的氨水1kg,计算此氨水的物质的量的浓度为多少
(3)常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体总物质的量保持不变。求:
① 反应前氯气和氨气的物质的量之比为多少
② 反应后生成的氧化产物的质量为多少
(4)已知氨气和氯气混合可发生下列反应: 2NH3+3Cl2 → 6HCl+N2,NH3+HCl → NH4Cl 现有Cl2和NH3共aL,混合后充分反应,气体体积变为bL,问有多少升的NH3被氧化
您最近一年使用:0次
3 . 碳酸钾与碳酸氢钾都是重要的化学试剂与工业原料,具有广泛的用途.
(1)将碳酸钾、石灰石和二氧化硅进行高温煅烧,可得到组成为K2O•CaO•6SiO2的钾玻璃,同时排出CO2.若制造5.1kg钾玻璃,排放的CO2在标准状况下的体积是_____ L.
(2)已知亚硫酸的酸性强于碳酸.工业上用碳酸钾与碳酸氢钾的混合溶液吸收SO2,充分反应后,所得溶液组成如下表:
计算原吸收液中碳酸钾与碳酸氢钾的物质的量之比_______________ .
(3)根据上表中的数据,计算上表的混合溶液还能吸收SO2的最大质量(不计SO2的溶解)._____________
(4)将热的浓CuSO4溶液与K2CO3溶液混合,析出物中有一种蓝色粒状晶体(不含结晶水),式量为376,其中钾元素的质量分数为0.104.取0.02mol该晶体溶于足量的稀盐酸中,没有气体产生,再加入BaCl2,产生9.32g白色沉淀,通过计算推断晶体的化学式.___
(1)将碳酸钾、石灰石和二氧化硅进行高温煅烧,可得到组成为K2O•CaO•6SiO2的钾玻璃,同时排出CO2.若制造5.1kg钾玻璃,排放的CO2在标准状况下的体积是
(2)已知亚硫酸的酸性强于碳酸.工业上用碳酸钾与碳酸氢钾的混合溶液吸收SO2,充分反应后,所得溶液组成如下表:
| 物质 | K2CO3 | KHCO3 | K2SO3 |
| 质量(kg) | 55.2 | 120.0 | 63.2 |
计算原吸收液中碳酸钾与碳酸氢钾的物质的量之比
(3)根据上表中的数据,计算上表的混合溶液还能吸收SO2的最大质量(不计SO2的溶解).
(4)将热的浓CuSO4溶液与K2CO3溶液混合,析出物中有一种蓝色粒状晶体(不含结晶水),式量为376,其中钾元素的质量分数为0.104.取0.02mol该晶体溶于足量的稀盐酸中,没有气体产生,再加入BaCl2,产生9.32g白色沉淀,通过计算推断晶体的化学式.
您最近一年使用:0次
2010·上海·二模
4 . 过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为c mol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度___ 。
(2)通过计算确定过碳酸钠的化学式___ 。
(3)工业上常以所含活性氧的质量分数[w(活性氧)= ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品___ 。(已知:2Na2S2O3+I2→Na2S4O6+2NaI)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
(1)计算稀硫酸的物质的量浓度
(2)通过计算确定过碳酸钠的化学式
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
 ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
您最近一年使用:0次
5 . 锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N__ g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是__ g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是__ L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度__ .(保留1位小数,LiOH的式量:23.94)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式__ ,写出制备碱式碳酸钴反应的化学方程式__ .
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数__ .(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数
您最近一年使用:0次
2020-03-22更新
|
156次组卷
|
2卷引用:上海市杨浦区2015年高考二模化学试题
6 . )含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为__________________
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3 min时达到新平衡。请在下图中画出t2~t4min内正逆反应速率的变化曲线(曲线上必须标明V正、 V逆)
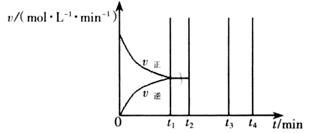
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。

①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为__________________
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3 min时达到新平衡。请在下图中画出t2~t4min内正逆反应速率的变化曲线(曲线上必须标明V正、 V逆)

(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。

①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
您最近一年使用:0次
7 . KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_________(填序号)
(2)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是__________ ;
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1mol•L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为_________ g;
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00ML。计算该KMnO4产品的纯度_________ (请给出计算过程)。(有关离子方程式为:MnO +S2O
+S2O +H+---SO
+H+---SO +Mn2++H2O 未配平)
+Mn2++H2O 未配平)
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_________(填序号)
| A.75%酒精 | B.双氧水 | C.苯酚 | D.84消毒液(NaClO溶液) |
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1mol•L-1标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00ML。计算该KMnO4产品的纯度
 +S2O
+S2O +H+---SO
+H+---SO +Mn2++H2O 未配平)
+Mn2++H2O 未配平)
您最近一年使用:0次
13-14高三上·上海杨浦·期末
8 . 硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2 Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
A是____ (写化学式)。若得到192克的硫磺,则产生标准状况下的A气体____ L。
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为__________________ 。
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程_______ 。(不考虑硫化氢的分解)
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3∙5H2O多少克?写出推导过程______ 。(已知:Na2S2O3的溶解度,10℃时为60.0g/100g水,100℃时为207g/100g水。100℃时,Na2S2O3饱和溶液的密度为1.14g/mL)。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2
 Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6SA是
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3∙5H2O多少克?写出推导过程
您最近一年使用:0次
2013·上海普陀·二模
解题方法
9 . 金属及其化合物变化多,用途广。请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是________________ (用a、b表示,只考虑空气中氮气、氧气参与反应)。
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度__________ 。
②计算并确定此种硬铝的化学式__________ 。
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a =_______ ,V =________ 。(气体体积均为标准状况)
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量_____ 。
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度
②计算并确定此种硬铝的化学式
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a =
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量
您最近一年使用:0次



