解题方法
1 . 人体必需的一些元素在周期表中的分布情况如下:
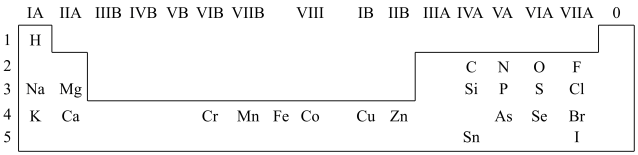
(1)请在上图中画出金属与非金属的分界线______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是______ (填字母)。
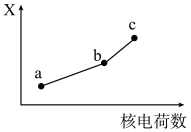
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。
(6)某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验②观察到的现象是______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是______ 。试从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下,______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl | H₂O | CO₂ | CH₄ |
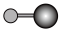 | 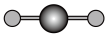 | 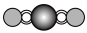 | 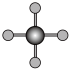 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅥA族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
(6)某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 |  |  |
| 现象 | 溶液变为黄色 |
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
名校
解题方法
2 . 查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒
(1)已知 能发生如下反应:
能发生如下反应: ,上述反应中氧化产物是
,上述反应中氧化产物是___________ ;HI在反应中体现了什么性质___________ 。(填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(2)根据上题反应,鉴别 和NaCl,可选择以下物质中的___________进行实验(填字母)。
和NaCl,可选择以下物质中的___________进行实验(填字母)。
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒(1)已知
 能发生如下反应:
能发生如下反应: ,上述反应中氧化产物是
,上述反应中氧化产物是A.氧化性 B.还原性 C.酸性 D.碱性
(2)根据上题反应,鉴别
 和NaCl,可选择以下物质中的___________进行实验(填字母)。
和NaCl,可选择以下物质中的___________进行实验(填字母)。| A.食用白醋 | B.碘化钾淀粉试纸 | C.淀粉 | D.水 |
您最近一年使用:0次
3 . 亚硝酸钠(NaNO2)为白色粉末,易溶于水,味微咸,有毒;广泛应用于工业建筑领域,允许限量做食品添加剂,用于防腐和肉制品增色。某化学小组对亚硝酸钠的性质和用途进行了如下探究。
(1)NaNO2中N元素的化合价为__ ,据此推断NaNO2__ (填字母)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作___________ (填“氧化剂”或“还原剂”)。
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入___________ (填“FeSO4溶液、KSCN溶液”或“酸性KMnO4溶液”),观察到的实验现象为___________ ,据此得出预测结论。
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3 2NaNO2+O2↑。
2NaNO2+O2↑。
途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式___________ 。
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为___________ 。
(1)NaNO2中N元素的化合价为
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3
 2NaNO2+O2↑。
2NaNO2+O2↑。途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
名校
4 . 某学习小组探究 溶液与
溶液与 溶液的反应。资料:①
溶液的反应。资料:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③
具有较强的氧化性;③ 溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜测1:发生复分解反应。
猜测2: 与
与 发生氧化还原反应。
发生氧化还原反应。
(1)①如果猜测2成立,则发生反应的化学方程式为___________ ;为了验证该猜测,甲同学往反应后的溶液中加入淀粉,观察到溶液变蓝,证明猜测2成立。
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为___________ ;该反应中的氧化剂和还原剂的物质的量之比为___________ 。
(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量)。
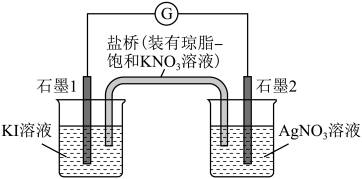
①该装置的负极为石墨___________ (填“1”或“2”)。
②电池反应一段时间后, 溶液逐渐变为黄色。丙同学从盛有
溶液逐渐变为黄色。丙同学从盛有 溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是
溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是 和
和 发生了氧化还原反应,是否合理?并说明理由
发生了氧化还原反应,是否合理?并说明理由___________ 。
③一段时间后,电流计指针发生偏转, 溶液无气泡产生,石墨2表面有银白色金属析出。由此可知,
溶液无气泡产生,石墨2表面有银白色金属析出。由此可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为___________ ,因此验证了 与
与 能发生氧化还原反应。若石墨2增重
能发生氧化还原反应。若石墨2增重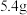 (不考虑其他反应),则电路中转移电子数为
(不考虑其他反应),则电路中转移电子数为___________ 。
 溶液与
溶液与 溶液的反应。资料:①
溶液的反应。资料:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③
具有较强的氧化性;③ 溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:
溶液暴露在空气中或久置会变为黄色。甲同学对两溶液可能发生的反应提出了下列两种猜想:猜测1:发生复分解反应。
猜测2:
 与
与 发生氧化还原反应。
发生氧化还原反应。(1)①如果猜测2成立,则发生反应的化学方程式为
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是
 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量)。

①该装置的负极为石墨
②电池反应一段时间后,
 溶液逐渐变为黄色。丙同学从盛有
溶液逐渐变为黄色。丙同学从盛有 溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是
溶液烧杯中取少量液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出是 和
和 发生了氧化还原反应,是否合理?并说明理由
发生了氧化还原反应,是否合理?并说明理由③一段时间后,电流计指针发生偏转,
 溶液无气泡产生,石墨2表面有银白色金属析出。由此可知,
溶液无气泡产生,石墨2表面有银白色金属析出。由此可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为 与
与 能发生氧化还原反应。若石墨2增重
能发生氧化还原反应。若石墨2增重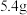 (不考虑其他反应),则电路中转移电子数为
(不考虑其他反应),则电路中转移电子数为
您最近一年使用:0次
5 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
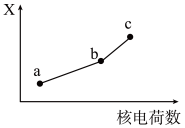
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:河北省石家庄市辛集市2023-2024学年高一上学期2月期末考试化学试题
名校
6 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: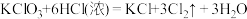 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
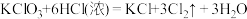 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
7 . 化学来源于生活,且应用于生活。请根据题意填空:
(1)钠有多种化合物,其中加工馒头、面包等产品时,可作膨松剂的是___________ (填“ ”或“NaCl”)。
”或“NaCl”)。
(2)开盖后的铁强化酱油(铁元素以 表示)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由
表示)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由 价升高到
价升高到 价,此转化过程体现了
价,此转化过程体现了 的
的___________ (填“氧化性”或“还原性”)。
(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有___________ (填“Fe2O3”或“Fe3O4”)。
(4)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,是因为Al和Al2O3均能与酸、碱反应。则Al2O3属于___________ (填“碱性”或“两性”)氧化物。
(5)我国发行的第五套人民币中,1角硬币的材质为铝合金。铝合金的硬度比纯铝的___________ (填“大”或“小”)。
(1)钠有多种化合物,其中加工馒头、面包等产品时,可作膨松剂的是
 ”或“NaCl”)。
”或“NaCl”)。(2)开盖后的铁强化酱油(铁元素以
 表示)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由
表示)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由 价升高到
价升高到 价,此转化过程体现了
价,此转化过程体现了 的
的(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有
(4)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,是因为Al和Al2O3均能与酸、碱反应。则Al2O3属于
(5)我国发行的第五套人民币中,1角硬币的材质为铝合金。铝合金的硬度比纯铝的
您最近一年使用:0次
名校
解题方法
8 . 人体必需的一些元素在周期表中的分布情况如下:___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________ 。

(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是
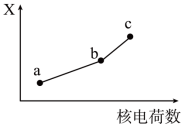
| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
名校
解题方法
9 . 人体必需的一些元素在周期表中的分布情况如下:______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是________ ,原子序数为____ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。
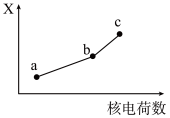
| A.若a、b、c表示氧族元素,则X表示对应氢化物的沸点 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅠA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2024-01-24更新
|
71次组卷
|
2卷引用:山东省东明县第一中学2023-2024学年高一下学期4月第一次月考化学试题
名校
解题方法
10 . “84消毒液”是家居常用的防疫用品,某化学小组同学查看包装说明,得到如下信息:
【有效成分】NaClO
【规格】1000mL
【浓度】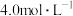
【使用说明】i.按一定比例稀释后使用。
ii.不得与酸性产品(如洁厕灵)同时使用。
小组同学进行了如下实验,回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成 的溶液。
的溶液。
①稀释时,需要取用___________ mL“84消毒液”原液。
②下列操作会使溶液中NaClO浓度偏低的是___________ (填标号)
A.取用久置的“84消毒液“原液进行稀释
B.量取“84消毒液“原液时,仰视读数
C.定容时,俯视刻度线
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)已知:洁厕灵的主要化学成分是盐酸。同学们利用示装置探究84消毒液与洁厕灵不能混用的原因。___________ ,淀粉KI试纸上发生反应的离子反应方程式为___________ 。
②棉花团蘸取的溶液A是___________ ,用离子方程式说明其作用是___________ 。
(3)某同学设计实验探究84消毒液(主要成分为次氯酸钠)的漂白性。
I.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
①实验I、II现象不同的原因是为___________ 。
②实验III的结论及可能原因是___________ 。
【有效成分】NaClO
【规格】1000mL
【浓度】
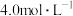
【使用说明】i.按一定比例稀释后使用。
ii.不得与酸性产品(如洁厕灵)同时使用。
小组同学进行了如下实验,回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成
 的溶液。
的溶液。①稀释时,需要取用
②下列操作会使溶液中NaClO浓度偏低的是
A.取用久置的“84消毒液“原液进行稀释
B.量取“84消毒液“原液时,仰视读数
C.定容时,俯视刻度线
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)已知:洁厕灵的主要化学成分是盐酸。同学们利用示装置探究84消毒液与洁厕灵不能混用的原因。
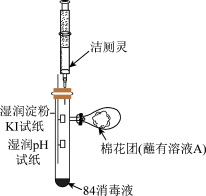
②棉花团蘸取的溶液A是
(3)某同学设计实验探究84消毒液(主要成分为次氯酸钠)的漂白性。
I.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
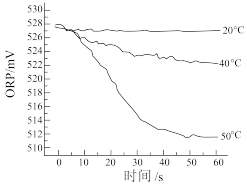
①实验I、II现象不同的原因是为
②实验III的结论及可能原因是
您最近一年使用:0次
2023-12-14更新
|
163次组卷
|
3卷引用:山东省潍坊市诸城繁华中学2023-2024学年高一1月学情检测化学试题



