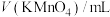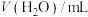名校
解题方法
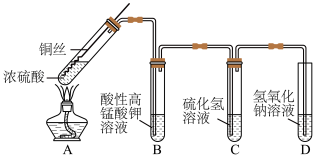
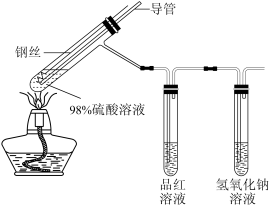
1 . 某化学实验小组的同学利用铜与浓硫酸反应制取二氧化硫并研究其性质,所用实验装置如下:
(1)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作是___________ 。
(2)用化学方程式表示氢氧化钠溶液的作用是___________ 。
(3)装置A中反应的化学方程式是___________ 。
(4)装置B中反应的离子方程式是___________ 。装置C中反应的化学方程式是___________ 。
(5)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有CuO、 和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是___________(填字母)。已知:
和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是___________(填字母)。已知: 、CuS不溶于稀硫酸。
、CuS不溶于稀硫酸。
(1)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作是
(2)用化学方程式表示氢氧化钠溶液的作用是
(3)装置A中反应的化学方程式是
(4)装置B中反应的离子方程式是
(5)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有CuO、
 和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是___________(填字母)。已知:
和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是___________(填字母)。已知: 、CuS不溶于稀硫酸。
、CuS不溶于稀硫酸。硫酸浓度/(mol·L ) ) | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
| A.取黑色物质洗涤、干燥后称量,加入足量稀硫酸充分混合,再取固体洗涤、干燥后称量,固体质量不变,说明黑色物质中不含CuO |
B.黑色物质消失过程中有 、 、 生成 生成 |
| C.相同条件下,硫酸浓度越大,反应速率越快,黑色物质越易出现、越易消失 |
| D.硫酸浓度为16 mol/L时,先升温至:250℃以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质 |
您最近一年使用:0次
名校
解题方法
2 . 将电能转化为化学能在生活、生产和科学研究中具有重要意义。某学习小组用石墨电极持续电解 溶液。
溶液。
(1)下列说法中正确的是___________ (填序号)。
①a极是阳极 ②通电后 开始电离
开始电离
③通电后 和
和 向阳极移动 ④总反应为:
向阳极移动 ④总反应为: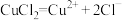
(2) 时刻,a极的电极反应式为
时刻,a极的电极反应式为___________ 。
(3) ~
~ ,b极产生刺激性气体,能使湿润的KI淀粉试纸变蓝,该气体是
,b极产生刺激性气体,能使湿润的KI淀粉试纸变蓝,该气体是___________ 。
(4)为证明a极的白色沉淀是CuCl,从a极刮取白色沉淀(含少量红色固体),进行如下实验:
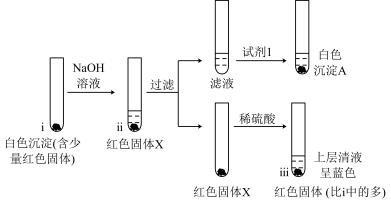
资料卡片:
①向试管i中加入NaOH溶液,生成的黄色沉淀很快转变为红色,补全物质的转化过程:CuCl→___________ → 。
。
②白色沉淀A为AgCl,试剂1是___________ 。
(5)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由氧化还原反应产生的,离子方程式为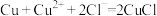
假设2:由电极反应产生:___________ 。
(6) 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体,该气体可能是
时a极产生气体,该气体可能是___________ 。
 溶液。
溶液。| 实验 | 时刻 | 现象 |
 |  | a极析出红色固体b极产生气体 |
 | a极产生白色沉淀;a极附近溶液变为黄绿色;b极产生气体 | |
| … | …… | |
 | a极产生气体;b极产生气体 |
(1)下列说法中正确的是
①a极是阳极 ②通电后
 开始电离
开始电离 ③通电后
 和
和 向阳极移动 ④总反应为:
向阳极移动 ④总反应为: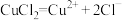
(2)
 时刻,a极的电极反应式为
时刻,a极的电极反应式为(3)
 ~
~ ,b极产生刺激性气体,能使湿润的KI淀粉试纸变蓝,该气体是
,b极产生刺激性气体,能使湿润的KI淀粉试纸变蓝,该气体是(4)为证明a极的白色沉淀是CuCl,从a极刮取白色沉淀(含少量红色固体),进行如下实验:

资料卡片:
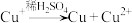 ,CuOH(黄色,不溶)→ ,CuOH(黄色,不溶)→ (红色,不溶) (红色,不溶) |
 。
。②白色沉淀A为AgCl,试剂1是
(5)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由氧化还原反应产生的,离子方程式为
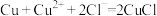
假设2:由电极反应产生:
(6)
 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体,该气体可能是
时a极产生气体,该气体可能是
您最近一年使用:0次
2024-01-21更新
|
97次组卷
|
3卷引用:北京市西城外国语学校2023-2024学年高二上学期期中考试化学试题
北京市西城外国语学校2023-2024学年高二上学期期中考试化学试题(已下线)专题08 电解池 金属的腐蚀与防护-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)宁夏回族自治区石嘴山市第三中学2023-2024学年高二上学期1月期末化学试题
3 . 用脱脂棉包住约0.2g 粉末,置于石棉网上,往脱脂棉上滴水(如图),可观察到脱脂棉剧烈燃烧起来。
粉末,置于石棉网上,往脱脂棉上滴水(如图),可观察到脱脂棉剧烈燃烧起来。
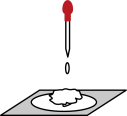
(1)由实验现象所得出的有关 和
和 反应的结论如下,请补充完整:
反应的结论如下,请补充完整:
a.有___________ 生成;b.反应放热
(2)某研究性学习小组拟用如图装置进行实验,以证明上述结论。
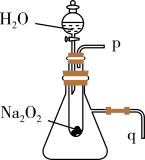
用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到___________ ,证明反应是放热的。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有 ,使酚酞氧化导致颜色褪去。同学们向反应后溶液中加入
,使酚酞氧化导致颜色褪去。同学们向反应后溶液中加入___________ ,可观察到___________ ,说明有 存在。
存在。
(4)向 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法正确的是___________
溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法正确的是___________
(5)资料显示, 与干燥的HCl能发生化学反应生成
与干燥的HCl能发生化学反应生成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
 粉末,置于石棉网上,往脱脂棉上滴水(如图),可观察到脱脂棉剧烈燃烧起来。
粉末,置于石棉网上,往脱脂棉上滴水(如图),可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关
 和
和 反应的结论如下,请补充完整:
反应的结论如下,请补充完整:a.有
(2)某研究性学习小组拟用如图装置进行实验,以证明上述结论。

用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有
 ,使酚酞氧化导致颜色褪去。同学们向反应后溶液中加入
,使酚酞氧化导致颜色褪去。同学们向反应后溶液中加入 存在。
存在。(4)向
 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法正确的是___________
溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法正确的是___________A. 是 是 分解反应的催化剂 分解反应的催化剂 |
B. 既表现氧化性又表现还原性 既表现氧化性又表现还原性 |
C. 将 将 还原为 还原为 |
D. 将 将 氧化为 氧化为 |
(5)资料显示,
 与干燥的HCl能发生化学反应生成
与干燥的HCl能发生化学反应生成 ,该反应的化学方程式为:
,该反应的化学方程式为:
您最近一年使用:0次
名校
4 . 研究小组探究高铜酸钠(NaCuO2)的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:_____ ;制备时滴加的CuCl2溶液不宜过量。
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是______ 。
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是______ 。
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:___________ 。
②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,___________ 。
ii.提出假设2:___________ ,经证实该假设也成立。
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是___________ 。
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、___________ 溶液和___________ 溶液。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和
 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,
ii.提出假设2:
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、
您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素.配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液,将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)表格中
_________ ,实验①和②的目的是___________ .
(2)甲认为上述实验应控制 相同,可加入的试剂是
相同,可加入的试剂是__________ (填序号).
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液 调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
资料:(a) 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生了 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:____________________________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图.
浓度随时间的变化如下图.

(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为______________ .
(5)实验②在第ii阶段的反应速率较大,可能的原因是____________ .
(6)为了验证上述(5)中说法,设计如下实验:在第ii阶段将 调节至
调节至 ,现象是
,现象是____________ ,由此现象可证明上述猜想合理。
【结论与反思】
结论:反应可能是分阶段进行的草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
序号 |
| V(草酸)/mL |
| 反应温度/℃ |
① | 2.0 | 2.0 | 0 | 20 |
② | 2.0 | 1.0 |
| 20 |
(1)表格中

(2)甲认为上述实验应控制
 相同,可加入的试剂是
相同,可加入的试剂是a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液
 调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.资料:(a)
 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生了
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图.
浓度随时间的变化如下图.
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)为了验证上述(5)中说法,设计如下实验:在第ii阶段将
 调节至
调节至 ,现象是
,现象是【结论与反思】
结论:反应可能是分阶段进行的草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
名校
解题方法
6 . 硫酸渣是硫酸生产过程中产生的固体废料,主要化学成分有 、
、 、
、 等。
等。
I.研究人员可利用硫酸渣制备高纯度硫酸亚铁晶体,流程如下图所示:
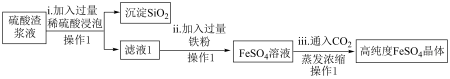
已知: 是难溶于水的酸性氧化物。
是难溶于水的酸性氧化物。
(1)操作1是______ 。
(2)步骤ii中涉及反应的离子方程式有_______ 、_________ 。
(3)步骤iii中的 的作用是
的作用是______ 。
(4)取少量高纯度 晶体配成溶液,
晶体配成溶液,_______ (操作和现象),证明该晶体中不含 。
。
Ⅱ.研究人员还可利用硫酸渣与含氯废气( 和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
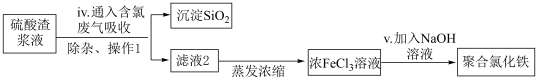
已知:聚合氯化铁的一种形式为 。
。
(5)写出以下物质中加点元素 的化合价: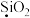
_____ ,
_____ 。
(6)下列关于步骤iv中含氯废气作用的说法中,不正确的是___________ 。
a.盐酸中 作用是使FeO、
作用是使FeO、 溶解
溶解
b.氯气参与反应的离子方程式为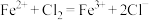
c.盐酸与氯气中的氯元素均转移到 中
中
(7)补全步骤v中涉及到反应的化学方程式______ 。
 。
。
 、
、 、
、 等。
等。I.研究人员可利用硫酸渣制备高纯度硫酸亚铁晶体,流程如下图所示:

已知:
 是难溶于水的酸性氧化物。
是难溶于水的酸性氧化物。(1)操作1是
(2)步骤ii中涉及反应的离子方程式有
(3)步骤iii中的
 的作用是
的作用是(4)取少量高纯度
 晶体配成溶液,
晶体配成溶液, 。
。Ⅱ.研究人员还可利用硫酸渣与含氯废气(
 和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
已知:聚合氯化铁的一种形式为
 。
。(5)写出以下物质中
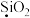

(6)下列关于步骤iv中含氯废气作用的说法中,不正确的是
a.盐酸中
 作用是使FeO、
作用是使FeO、 溶解
溶解b.氯气参与反应的离子方程式为
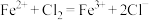
c.盐酸与氯气中的氯元素均转移到
 中
中(7)补全步骤v中涉及到反应的化学方程式
 。
。
您最近一年使用:0次
名校
解题方法
7 . 某兴趣小组同学探究 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。
【设计实验】
(1)表格中
_____ ,实验①和②的目的是_____ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_____ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a) 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应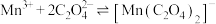 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:_____ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。

(4)第ⅰ阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_____ 。
(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是_____ 。
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是_____ ,由此现象可证明上述猜想合理。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是_____ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。【设计实验】
| 序号 |  /mL /mL | V(草酸)/mL |  /mL /mL | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | x | 20 |

(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a)
 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应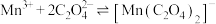 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了
 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第ⅰ阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将
 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
名校
解题方法
8 . 某化学实验小组的同学利用铜与浓硫酸反应制取二氧化硫并研究其性质,所用实验装置如下:
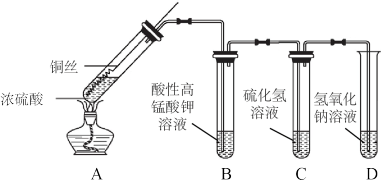
回答下列问题:
(1)将铜丝下端卷成螺旋状的理由是_______ 。
(2)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作是_______ 。
(3)用化学方程式表示氢氧化钠溶液的作用是_______ 。
(4)装置A中反应的化学方程式是_______ 。
(5)装置B和装置C分别验证了二氧化硫的_______ 性质。
(6)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是_______(填字母)。已知:Cu2S、CuS不溶于稀硫酸。

回答下列问题:
(1)将铜丝下端卷成螺旋状的理由是
(2)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作是
(3)用化学方程式表示氢氧化钠溶液的作用是
(4)装置A中反应的化学方程式是
(5)装置B和装置C分别验证了二氧化硫的
(6)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是_______(填字母)。已知:Cu2S、CuS不溶于稀硫酸。
| 硫酸浓度/(mol· L-1) | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
| A.取黑色物质洗涤、干燥后称量,加入足量稀硫酸充分混合,再取固体洗涤、干燥后称量,固体质量不变,说明黑色物质中不含CuO |
| B.黑色物质消失过程中有SO2、H2S生成 |
| C.相同条件下,硫酸浓度越大,反应速率越快,黑色物质越易出现、越易消失 |
| D.硫酸浓度为16mol/L时,先升温至250°C以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质 |
您最近一年使用:0次
2022-04-27更新
|
230次组卷
|
2卷引用:北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题
9 . 某化学兴趣小组同学在探究金属与酸的反应时,发现铜片与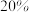 的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应呢?”,并进行了系列实验。
的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应呢?”,并进行了系列实验。
(1)【查阅资料】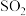 是有刺激性气味的无色气体,有毒,能使红色的品红溶液褪色,能被
是有刺激性气味的无色气体,有毒,能使红色的品红溶液褪色,能被 溶液吸收。
溶液吸收。
【进行实验】(夹持仪器略)
实验1∶初步实验(所用溶液均为硫酸溶液)
经检验实验1-1中产生的气体是氢气。
实验2:实验1-5基础上深入探究,装置如下图。
【解释与结论】
①实验1-1中,能证明铜发生反应的现象是___________ 。
②实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是___________ (填实验序号)。
③补全实验1-5和实验2中铜与硫酸反应的化学方程式: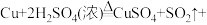
_______ 。
④与实验1-5相比,实验2的优点有___________ 。(写出一条即可)。
⑤通过上述实验能得出的结论是___________ 。
(2)【反思与评价】
下列说法不正确 的是___________。
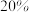 的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应呢?”,并进行了系列实验。
的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应呢?”,并进行了系列实验。(1)【查阅资料】
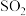 是有刺激性气味的无色气体,有毒,能使红色的品红溶液褪色,能被
是有刺激性气味的无色气体,有毒,能使红色的品红溶液褪色,能被 溶液吸收。
溶液吸收。【进行实验】(夹持仪器略)
实验1∶初步实验(所用溶液均为硫酸溶液)
| 序号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 |
| 装置 |  | 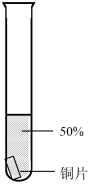 | 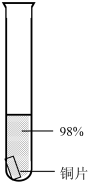 |  | 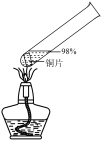 |
| 主要现象 | 铜片a附近溶液逐渐变蓝,铜片b附近产生无色气泡 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
实验2:实验1-5基础上深入探究,装置如下图。

【解释与结论】
①实验1-1中,能证明铜发生反应的现象是
②实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是
③补全实验1-5和实验2中铜与硫酸反应的化学方程式:
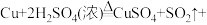
④与实验1-5相比,实验2的优点有
⑤通过上述实验能得出的结论是
(2)【反思与评价】
下列说法
| A.对比实验1-2和1-5,可得出“增大浓度可使铜与硫酸反应” |
| B.通电可促进一些化学反应的发生 |
| C.铜与硫酸只能发生一种化学反应 |
| D.造成反应多样性的主要因素有反应物的浓度、温度等 |
您最近一年使用:0次
名校
解题方法
10 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:北京市一零一中2021-2022学年高一上学期期中考试化学试题