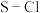解题方法
1 . 我国化工专家侯德榜提出“侯氏制碱法”为国际制碱工业做出了重大贡献。他以NaCl、 、
、 等为原料先制得
等为原料先制得 ,进而生产出
,进而生产出 。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 。实验流程如图:
。实验流程如图:
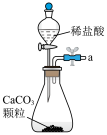
(1)整个实验流程需要___________ 次过滤操作;能够循环利用的是___________ ;
(2)制备 的总反应的化学方程式为
的总反应的化学方程式为___________ ;
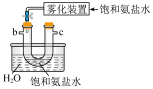
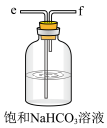
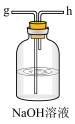
(3)模拟实验时使用下列装置制备 ,请正确的连接装置顺序是
,请正确的连接装置顺序是___________ (按气流方向,用小写字母表示):
(4)上述装置A中反应的离子方程式___________ ,装置B中使用雾化装置的优点是___________ ;装置D的作用是___________ 。
 、
、 等为原料先制得
等为原料先制得 ,进而生产出
,进而生产出 。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 。实验流程如图:
。实验流程如图: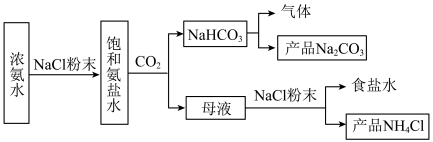
(1)整个实验流程需要
(2)制备
 的总反应的化学方程式为
的总反应的化学方程式为(3)模拟实验时使用下列装置制备
 ,请正确的连接装置顺序是
,请正确的连接装置顺序是
|
|
| |
| A | B | C | D |
您最近一年使用:0次
解题方法
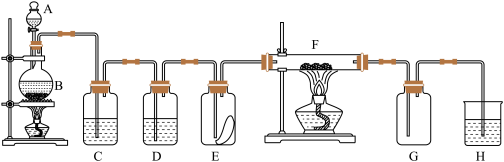
2 . 如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条,F中为红色的铜网,其右端出气管口放有脱脂棉。___________ 。
(2)装置C中盛装的溶液是___________ ,D中试剂的作用是___________ 。
(3)E中红色布条是否褪色?___________ (填“是”或“否”),F中的反应产物为___________ 。
(4)新制氯水呈酸性,分别写出盐酸和次氯酸的电离方程式___________ ,___________ 。
(5)若H中选用NaOH溶液进行尾气处理,则发生的反应是(用离子方程式表示)___________ 。
(2)装置C中盛装的溶液是
(3)E中红色布条是否褪色?
(4)新制氯水呈酸性,分别写出盐酸和次氯酸的电离方程式
(5)若H中选用NaOH溶液进行尾气处理,则发生的反应是(用离子方程式表示)
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
|
解题方法
3 . 实验室配制480mL0.2mol/L的NaOH溶液,实验操作步骤有:
A.在天平上称取一定质量的氢氧化钠固体,用适量的蒸馏水使它完全溶解并冷却至室温;
B.把制得的溶液小心地转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至___________;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶并轻轻振荡;
E.将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)操作步骤的正确顺序为(填序号)___________ 。
(2)操作A中,在天平上称取氢氧化钠固体的质量为___________ g。
(3)本实验用到的基本仪器已经有烧杯、天平(带砝码、镊子)、药匙、玻璃棒,还缺少的仪器是___________ 。
(4)请将操作C中缺少的文字补充完整___________ 。
(5)配制溶液时,下列操作中引起误差偏高的有___________ 。(填序号)
A.药品久置发生变质
B.原容量瓶配制溶液前未干燥
C.氢氧化钠溶液未冷却至室温就转移至容量瓶
D.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
E.定容时,俯视刻度线
(6)下列操作中,容量瓶所不具备的功能有___________ 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
A.在天平上称取一定质量的氢氧化钠固体,用适量的蒸馏水使它完全溶解并冷却至室温;
B.把制得的溶液小心地转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至___________;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶并轻轻振荡;
E.将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)操作步骤的正确顺序为(填序号)
(2)操作A中,在天平上称取氢氧化钠固体的质量为
(3)本实验用到的基本仪器已经有烧杯、天平(带砝码、镊子)、药匙、玻璃棒,还缺少的仪器是
(4)请将操作C中缺少的文字补充完整
(5)配制溶液时,下列操作中引起误差偏高的有
A.药品久置发生变质
B.原容量瓶配制溶液前未干燥
C.氢氧化钠溶液未冷却至室温就转移至容量瓶
D.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
E.定容时,俯视刻度线
(6)下列操作中,容量瓶所不具备的功能有
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
您最近一年使用:0次
4 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 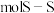 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有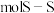 键。
键。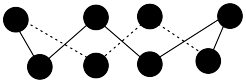
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
5 . 目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。___________ 。
(2)温度降低,平衡常数K___________ (填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率 (H2)为
(H2)为____________ mol·L-1·min-1, CO2和H2的转化率比是___________ 。___________ 。
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。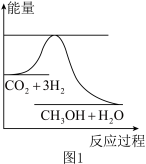
(2)温度降低,平衡常数K
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率
 (H2)为
(H2)为
您最近一年使用:0次
解题方法
6 . 某化学兴趣小组用浓盐酸与MnO2制备并收集纯净的氯气,回答下列问题。
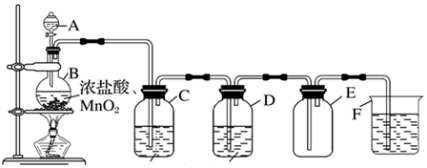
(1)仪器A名称_______ ,利用该装置制氯气的化学方程式为_______ 。
(2)C中溶液的试剂是_______ ,D的作用是______ 。
(3)装置F的作用______ ,涉及的主要离子反应方程式_______ 。

(1)仪器A名称
(2)C中溶液的试剂是
(3)装置F的作用
您最近一年使用:0次
名校
7 . 硫及其化合物的“价-类”二维图体现了化学变化之美。
(1)自然界中有斜方硫和单斜硫,它们的关系是______ (填“同位素”或“同素异形体”),二者转化属于化学变化。
(2)如图中属于酸性氧化物的物质是______ (用化学式表示)。
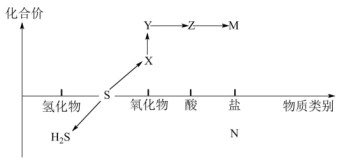
(3)不同价态的硫元素可以相互转化,请写出符合下列转化条件的化学方程式:
反应前后存在3种价态的硫元素的化学方程式______ 。
(4)如果有反应 ,
,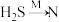 ,M是下列物质中的
,M是下列物质中的______ (填字母序号)
a. b.
b. c.
c. d.
d.
Q可以是______ (用化学式表示,写出至少2类物质)。
(5) 和
和 均为重要的化工产品。已知
均为重要的化工产品。已知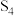 的结构式
的结构式 和有关化学键能如下,则反应
和有关化学键能如下,则反应
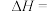
______  。
。
(6) 是一种优良的绝缘气体,分子结构中只存在
是一种优良的绝缘气体,分子结构中只存在 键。已知:
键。已知: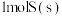 转化为气态硫原子吸收能量
转化为气态硫原子吸收能量 ,断裂
,断裂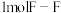 、
、 键需要吸收的能量分别为
键需要吸收的能量分别为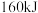 、
、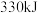 。则
。则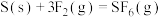 的反应热
的反应热 为
为______ 。
(1)自然界中有斜方硫和单斜硫,它们的关系是
(2)如图中属于酸性氧化物的物质是

(3)不同价态的硫元素可以相互转化,请写出符合下列转化条件的化学方程式:
反应前后存在3种价态的硫元素的化学方程式
(4)如果有反应
 ,
,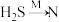 ,M是下列物质中的
,M是下列物质中的a.
 b.
b. c.
c. d.
d.
Q可以是
(5)
 和
和 均为重要的化工产品。已知
均为重要的化工产品。已知 的结构式
的结构式 和有关化学键能如下,则反应
和有关化学键能如下,则反应
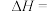
 。
。化学键 |
|
|
|
键能 | 266 | 255 | 243 |
 是一种优良的绝缘气体,分子结构中只存在
是一种优良的绝缘气体,分子结构中只存在 键。已知:
键。已知: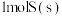 转化为气态硫原子吸收能量
转化为气态硫原子吸收能量 ,断裂
,断裂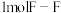 、
、 键需要吸收的能量分别为
键需要吸收的能量分别为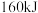 、
、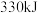 。则
。则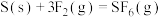 的反应热
的反应热 为
为
您最近一年使用:0次
8 . 氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水 遇潮湿空气即产生大量白雾),可用下列装置制备。
遇潮湿空气即产生大量白雾),可用下列装置制备。
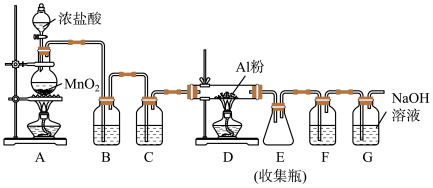
(1)装置B中盛放溶液为______ ,F的作用是______
(2)装置A实验开始前,应先______ ,接下来的操作依次是______ (填序号)。
A.往烧瓶中加入 粉末 B.加热 C.往烧瓶中加入浓盐酸
粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为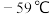 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。
,液态为黄绿色。
①设计最简单的实验验证 中含有
中含有 :收集一试管气体,盖上胶塞,放入冰水混合物中,若
:收集一试管气体,盖上胶塞,放入冰水混合物中,若______ ,则证明 中含有
中含有 。
。
②将过硫酸钠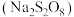 溶液加入亚氯酸钠
溶液加入亚氯酸钠 中可制备
中可制备 ,
, 中
中 元素的化合价是
元素的化合价是______ ,该反应中氧化剂和还原剂的物质的量之比为______ (已知:过硫酸钠反应后产物为 )
)
(4)G中发生的化学反应方程式为______ 。
 遇潮湿空气即产生大量白雾),可用下列装置制备。
遇潮湿空气即产生大量白雾),可用下列装置制备。
(1)装置B中盛放溶液为
(2)装置A实验开始前,应先
A.往烧瓶中加入
 粉末 B.加热 C.往烧瓶中加入浓盐酸
粉末 B.加热 C.往烧瓶中加入浓盐酸(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量
 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为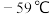 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。
,液态为黄绿色。①设计最简单的实验验证
 中含有
中含有 :收集一试管气体,盖上胶塞,放入冰水混合物中,若
:收集一试管气体,盖上胶塞,放入冰水混合物中,若 中含有
中含有 。
。②将过硫酸钠
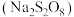 溶液加入亚氯酸钠
溶液加入亚氯酸钠 中可制备
中可制备 ,
, 中
中 元素的化合价是
元素的化合价是 )
)(4)G中发生的化学反应方程式为
您最近一年使用:0次
名校
9 . 熔盐级硝酸钠大量应用于太阳能储热介质,一种以工业纯碱(纯度为98%,杂质为 )和生产硝酸产生的
)和生产硝酸产生的 ,废气(含
,废气(含 、
、 )为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
)为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:

已知:①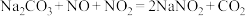 ;
;
② 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;
③ 的溶解度随温度的升高而升高,而
的溶解度随温度的升高而升高,而 的溶解度随温度变化较小。
的溶解度随温度变化较小。
(1)中和液所含溶质除 及少量
及少量 外,还有
外,还有______ (填化学式)。
(2)母液A加入稀硝酸生成有 。写出“转化”时加入稀硝酸反应的离子方程式
。写出“转化”时加入稀硝酸反应的离子方程式______ 。
(3)“洗涤”时可以使用母液______ (填“A”或“B”)。
(4)“步骤3”需要高温分离 固体。原因是
固体。原因是______ ,母液D可返回步骤______ (填“2”或“3”)循环使用。
(5)若得到 、
、 两种产品的物质的量之比为
两种产品的物质的量之比为 ,假定
,假定 恰好完全反应,则生产1.38吨
恰好完全反应,则生产1.38吨 时,工业纯碱的理论用量为
时,工业纯碱的理论用量为______ 吨(保留3位有效数字)。
 )和生产硝酸产生的
)和生产硝酸产生的 ,废气(含
,废气(含 、
、 )为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
)为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
已知:①
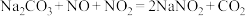 ;
;②
 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;③
 的溶解度随温度的升高而升高,而
的溶解度随温度的升高而升高,而 的溶解度随温度变化较小。
的溶解度随温度变化较小。(1)中和液所含溶质除
 及少量
及少量 外,还有
外,还有(2)母液A加入稀硝酸生成有
 。写出“转化”时加入稀硝酸反应的离子方程式
。写出“转化”时加入稀硝酸反应的离子方程式(3)“洗涤”时可以使用母液
(4)“步骤3”需要高温分离
 固体。原因是
固体。原因是(5)若得到
 、
、 两种产品的物质的量之比为
两种产品的物质的量之比为 ,假定
,假定 恰好完全反应,则生产1.38吨
恰好完全反应,则生产1.38吨 时,工业纯碱的理论用量为
时,工业纯碱的理论用量为
您最近一年使用:0次
10 . 将电能转化为化学能在生活生产和科学研究中具有重要意义。某学习小组用石墨电极持续电解CuCl2溶液。
【实验探究】
(1)t1~t3,b极产生的气体有刺激性气味,用湿润的碘化钾淀粉试纸检验,试纸变蓝,气体是_______ 。
(2)t1时刻,a极析出铜的电极反应式为_______ 。
(3)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知:Cu+ Cu+Cu2+,CuOH(黄色,不溶)→Cu2O(红色,不溶)
Cu+Cu2+,CuOH(黄色,不溶)→Cu2O(红色,不溶)
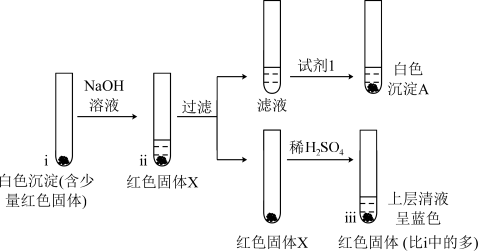
①白色沉淀A为AgCl,试剂1是_______ 。
②向试管i中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释该现象的化学方程式为_______ 。
③证实从a极刮取的白色沉淀中含有CuCl的理由是_______ 。
(4)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生:Cu2++Cl-+e-=CuCl↓。
假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:_______ 。
(5)t1时a极未产生气体,而t3时a极产生气体。原因是_______ 。
【应用实践】
(6)镀铜工业中,电镀液以CuSO4、H2SO4为主,同时含Cl-和添加剂。过多的Cl-会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量Ag2SO4(微溶)固体能有效解决该问题,解释Ag2SO4的作用_______ ;若加入AgNO3,固体效果是否会更好,说明理由_______ 。
【实验探究】
| 实验 | 时刻 | 现象 |
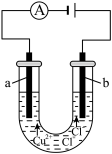 | t1 | a极析出红色固体;b极产生气体 |
| t2 | a极产生白色沉淀;a极附近溶液变为黄绿色;b极产生气体 | |
| … | …… | |
| t3 | a极产生气体;b极产生气体 |
(1)t1~t3,b极产生的气体有刺激性气味,用湿润的碘化钾淀粉试纸检验,试纸变蓝,气体是
(2)t1时刻,a极析出铜的电极反应式为
(3)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知:Cu+
 Cu+Cu2+,CuOH(黄色,不溶)→Cu2O(红色,不溶)
Cu+Cu2+,CuOH(黄色,不溶)→Cu2O(红色,不溶)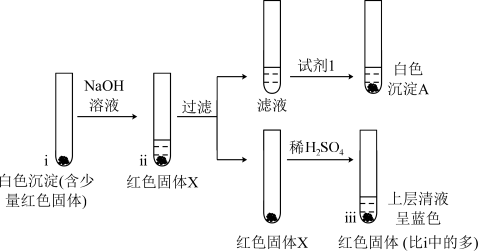
①白色沉淀A为AgCl,试剂1是
②向试管i中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释该现象的化学方程式为
③证实从a极刮取的白色沉淀中含有CuCl的理由是
(4)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生:Cu2++Cl-+e-=CuCl↓。
假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:
(5)t1时a极未产生气体,而t3时a极产生气体。原因是
【应用实践】
(6)镀铜工业中,电镀液以CuSO4、H2SO4为主,同时含Cl-和添加剂。过多的Cl-会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量Ag2SO4(微溶)固体能有效解决该问题,解释Ag2SO4的作用
您最近一年使用:0次