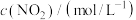2024·黑龙江吉林·模拟预测
解题方法
1 . 乙苯是生产苯乙烯的一种重要工业原料,工业上一般采用苯烷基化法制取乙苯。回答下列问题:
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)______ (填字母),反应③在热力学上能实现的温度范围为_______ 。______ eV,该步基元反应的化学方程式为______ 。
②能提高反应①平衡转化率的适宜条件为_______ (填字母)。
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
乙苯的选择性=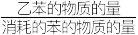 ×100%
×100%
Ka为为物质的量分数平衡常数_______ 。
(4)反应最适宜的时间为_______ (填字母)。
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=______ 。
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)
②C2H4(g)+ (g)=
(g)= (g)
(g)
③C2H6(g)+ (g)=
(g)= (g)+H2(g)
(g)+H2(g)


②能提高反应①平衡转化率的适宜条件为
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
④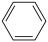 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)= (g)+HCl(g)
(g)+HCl(g)
⑤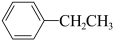 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)=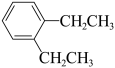 (g)+HCl(g)
(g)+HCl(g)
乙苯的选择性=
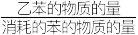 ×100%
×100%Ka为为物质的量分数平衡常数

(4)反应最适宜的时间为
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=
您最近一年使用:0次
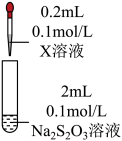
2 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.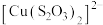 (淡绿色)、
(淡绿色)、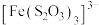 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+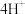
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
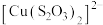 (淡绿色)、
(淡绿色)、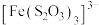 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+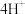
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。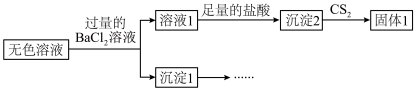
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
解题方法
3 . 利用γ-丁内酯 制备1,4-丁二醇
制备1,4-丁二醇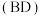 ,反应过程中伴有生成四氢呋喃
,反应过程中伴有生成四氢呋喃 和1-丁醇
和1-丁醇 的副反应,涉及反应如下:
的副反应,涉及反应如下: 氛围下进行,故
氛围下进行,故 压强近似等于总压。回答下列问题:
压强近似等于总压。回答下列问题:
(1)以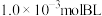 或
或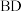 为初始原料,在
为初始原料,在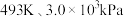 的高压
的高压 氛围下,分别在恒压容器中进行反应。达平衡时,以
氛围下,分别在恒压容器中进行反应。达平衡时,以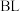 为原料,体系向环境放热
为原料,体系向环境放热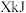 ,转化率为α;以
,转化率为α;以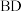 为原料,体系从环境吸热
为原料,体系从环境吸热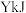 ,转化率为
,转化率为 。忽略副反应,反应Ⅰ焓变
。忽略副反应,反应Ⅰ焓变
_______  与
与 的数学关系为
的数学关系为_______ 。
(2)初始条件同上。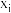 表示某物种i的物质的量与除
表示某物种i的物质的量与除 外其它各物种总物质的量之比,
外其它各物种总物质的量之比,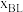 和
和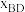 随时间t变化关系如图1所示。实验测得
随时间t变化关系如图1所示。实验测得 ,则图中表示初始反应物为
,则图中表示初始反应物为_______ (填“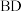 ”或“
”或“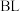 ”)时的变化关系;反应Ⅰ平衡常数
”)时的变化关系;反应Ⅰ平衡常数
_______  (保留两位有效数字)。以
(保留两位有效数字)。以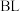 为原料时,
为原料时, 时刻
时刻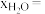
_______ ,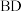 产率=
产率=_______ (保留两位有效数字)。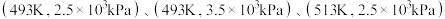 三种条件下,以
三种条件下,以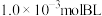 为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压
为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件
氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件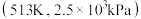 的是
的是_______ (填代号);与曲线b相比,曲线c达到平衡所需时间更长,原因是_______ 。
 制备1,4-丁二醇
制备1,4-丁二醇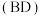 ,反应过程中伴有生成四氢呋喃
,反应过程中伴有生成四氢呋喃 和1-丁醇
和1-丁醇 的副反应,涉及反应如下:
的副反应,涉及反应如下:
 氛围下进行,故
氛围下进行,故 压强近似等于总压。回答下列问题:
压强近似等于总压。回答下列问题:(1)以
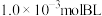 或
或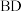 为初始原料,在
为初始原料,在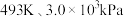 的高压
的高压 氛围下,分别在恒压容器中进行反应。达平衡时,以
氛围下,分别在恒压容器中进行反应。达平衡时,以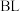 为原料,体系向环境放热
为原料,体系向环境放热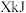 ,转化率为α;以
,转化率为α;以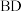 为原料,体系从环境吸热
为原料,体系从环境吸热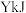 ,转化率为
,转化率为 。忽略副反应,反应Ⅰ焓变
。忽略副反应,反应Ⅰ焓变
 与
与 的数学关系为
的数学关系为(2)初始条件同上。
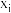 表示某物种i的物质的量与除
表示某物种i的物质的量与除 外其它各物种总物质的量之比,
外其它各物种总物质的量之比,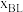 和
和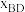 随时间t变化关系如图1所示。实验测得
随时间t变化关系如图1所示。实验测得 ,则图中表示初始反应物为
,则图中表示初始反应物为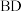 ”或“
”或“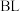 ”)时的变化关系;反应Ⅰ平衡常数
”)时的变化关系;反应Ⅰ平衡常数
 (保留两位有效数字)。以
(保留两位有效数字)。以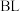 为原料时,
为原料时, 时刻
时刻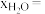
 产率=
产率=
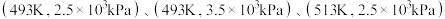 三种条件下,以
三种条件下,以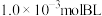 为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压
为初始原料,在相同体积的刚性容器中发生反应,反应物的转化率随时间t变化关系如图2所示。因反应在高压 氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件
氛围下进行,可忽略压强对反应速率的影响。曲线a、b、c中,对应条件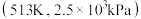 的是
的是
您最近一年使用:0次
名校
4 . 化合物J是一种EED抑制剂的中间体,其合成路线如下:
(1)C中含氧官能团的名称为__________ 。
(2)E的结构简式为__________ 。
(3)检验F中含碳碳双键的试剂为__________ 。
(4)C→D的反应类型为__________ 。
(5)已知A→B为取代反应,该反应的化学方程式为____________________ 。
(6)与B具有相同官能团且属于芳香族化合物的同分异构体共有__________ 种(不考虑立体异构)。
(7)根据题干信息,补全虚线框内剩余片段,使其合成路线完整__________ 。
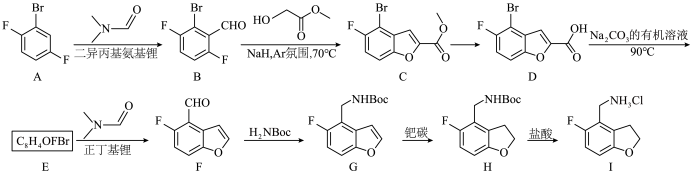
已知:—Boc代表 。
。
(1)C中含氧官能团的名称为
(2)E的结构简式为
(3)检验F中含碳碳双键的试剂为
(4)C→D的反应类型为
(5)已知A→B为取代反应,该反应的化学方程式为
(6)与B具有相同官能团且属于芳香族化合物的同分异构体共有
(7)根据题干信息,补全虚线框内剩余片段,使其合成路线完整

您最近一年使用:0次
2024-04-07更新
|
341次组卷
|
3卷引用:华大新高考联盟2024届高三4月教学质量测评理综-化学试题
5 . 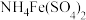 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
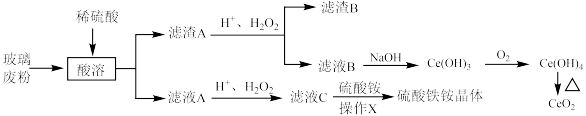
回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有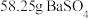 ,每次用
,每次用 的
的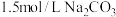 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;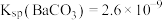 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为___________ 。
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率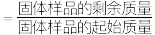
 。
。
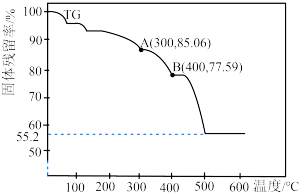
写出 的化学方程式:
的化学方程式:___________ 。
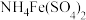 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
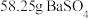 ,每次用
,每次用 的
的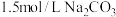 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;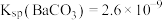 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率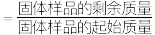
 。
。
写出
 的化学方程式:
的化学方程式:
您最近一年使用:0次
6 . 法国化学家Paul Sabatier研究得出 在催化剂作用下能够转化为甲烷,即反应I:
在催化剂作用下能够转化为甲烷,即反应I:
 。回答下列问题:
。回答下列问题:
(1)已知反应I的正反应活化能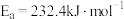 ,则逆反应的活化能为
,则逆反应的活化能为___________  ;反应I能够自发进行的条件是
;反应I能够自发进行的条件是___________ 。
(2)关于反应I及其相关说法正确的是___________ (填序号)。
① 转化为
转化为 可削弱温室效应
可削弱温室效应
②使用催化剂,可增加单位时间内活化分子有效碰撞次数
③增大压强有利于提高 的平衡转化率
的平衡转化率
④及时将 液化分离,有利于提高正反应速率
液化分离,有利于提高正反应速率
(3) 时,某刚性容器中充入
时,某刚性容器中充入 、
、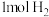 充分反应达到平衡,可能存在下图所示函数关系。
充分反应达到平衡,可能存在下图所示函数关系。
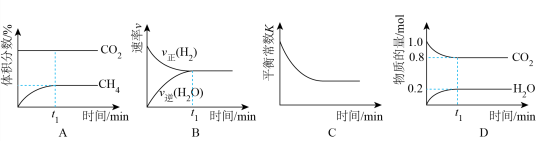
①某学生认为C图像一定错误,判断的依据是___________ 。
②上述图示中,还存在错误的是___________ (填字母)。
(4)在压强始终为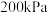 时,原料气按
时,原料气按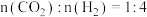 置于容器中引发反应
置于容器中引发反应 同时还会发生副反应:
同时还会发生副反应:
 。测得平衡时各物质的物质的量分数随温度的变化如图所示:
。测得平衡时各物质的物质的量分数随温度的变化如图所示:
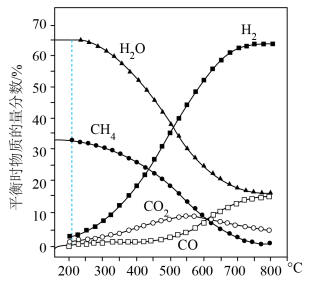
①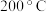 到
到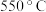 之间,
之间, 的物质的量分数随温度升高而增大的原因是
的物质的量分数随温度升高而增大的原因是___________ 。
②若实验测得反应 的正反应速率为
的正反应速率为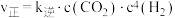 ,逆反应速率为
,逆反应速率为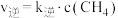
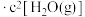 ,
, 为速率常数,升高温度时,
为速率常数,升高温度时, 的变化量较大的是
的变化量较大的是___________ (填“ ”或“
”或“ ”)
”)
③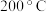 ,混合气体中几乎检测不出
,混合气体中几乎检测不出 ,则该温度下平衡常数
,则该温度下平衡常数
___________ 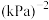 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数,结果保留整数)。
物质的量分数,结果保留整数)。
 在催化剂作用下能够转化为甲烷,即反应I:
在催化剂作用下能够转化为甲烷,即反应I:
 。回答下列问题:
。回答下列问题:(1)已知反应I的正反应活化能
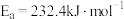 ,则逆反应的活化能为
,则逆反应的活化能为 ;反应I能够自发进行的条件是
;反应I能够自发进行的条件是(2)关于反应I及其相关说法正确的是
①
 转化为
转化为 可削弱温室效应
可削弱温室效应②使用催化剂,可增加单位时间内活化分子有效碰撞次数
③增大压强有利于提高
 的平衡转化率
的平衡转化率④及时将
 液化分离,有利于提高正反应速率
液化分离,有利于提高正反应速率(3)
 时,某刚性容器中充入
时,某刚性容器中充入 、
、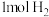 充分反应达到平衡,可能存在下图所示函数关系。
充分反应达到平衡,可能存在下图所示函数关系。
①某学生认为C图像一定错误,判断的依据是
②上述图示中,还存在错误的是
(4)在压强始终为
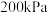 时,原料气按
时,原料气按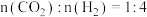 置于容器中引发反应
置于容器中引发反应 同时还会发生副反应:
同时还会发生副反应:
 。测得平衡时各物质的物质的量分数随温度的变化如图所示:
。测得平衡时各物质的物质的量分数随温度的变化如图所示:
①
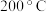 到
到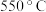 之间,
之间, 的物质的量分数随温度升高而增大的原因是
的物质的量分数随温度升高而增大的原因是②若实验测得反应
 的正反应速率为
的正反应速率为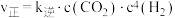 ,逆反应速率为
,逆反应速率为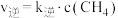
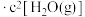 ,
, 为速率常数,升高温度时,
为速率常数,升高温度时, 的变化量较大的是
的变化量较大的是 ”或“
”或“ ”)
”)③
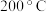 ,混合气体中几乎检测不出
,混合气体中几乎检测不出 ,则该温度下平衡常数
,则该温度下平衡常数
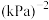 (用平衡分压代替平衡浓度计算,分压=总压
(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数,结果保留整数)。
物质的量分数,结果保留整数)。
您最近一年使用:0次
7 .  常用作橡胶硫化剂,是一种重要的化工原料。已知
常用作橡胶硫化剂,是一种重要的化工原料。已知 的熔点:
的熔点: ,沸点:
,沸点: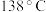 ,极易水解;实验室可通过
,极易水解;实验室可通过 与
与 在加热条件下化合生成
在加热条件下化合生成 。回答下列问题:
。回答下列问题:
(1)瑞典科学家舍勒加热 和浓盐酸的混合物首次制得了
和浓盐酸的混合物首次制得了 ,其反应的离子方程式为
,其反应的离子方程式为___________ ,实验室可用___________ 代替浓盐酸与 反应制得
反应制得 。
。
(2)制备 时,需要先制备
时,需要先制备 ,待
,待 充满装置后再加热盛有硫单质的硬质玻璃管,原因是
充满装置后再加热盛有硫单质的硬质玻璃管,原因是___________ 。
(3) 溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为
溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)通常采用“酸蒸馏-碘滴定法”测定 产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水
产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水 作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
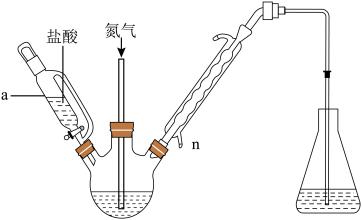
①仪器a的名称为___________ 。
②冷凝管中冷却液需从n管口进入,原因是___________ ;通入 的目的是
的目的是___________
③若四次平行实验,所加样品均为3.00g,消耗0.50mol/L碘标准溶液体积记录如下:
第一次数据不合理,可能原因是___________ (填字母)。
a.盛放0.50mol/L碘标准溶液的酸式滴定管未用标准液润洗
b.锥形瓶清洗后未干燥
c.初始时未进行赶气泡操作,有气泡残余,滴定后气泡消失
d.滴定终点读数时俯视读数
e.测定过程中氮气的流速过快
该样品的纯度为___________ (保留3位有效数字)。
 常用作橡胶硫化剂,是一种重要的化工原料。已知
常用作橡胶硫化剂,是一种重要的化工原料。已知 的熔点:
的熔点: ,沸点:
,沸点: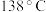 ,极易水解;实验室可通过
,极易水解;实验室可通过 与
与 在加热条件下化合生成
在加热条件下化合生成 。回答下列问题:
。回答下列问题:(1)瑞典科学家舍勒加热
 和浓盐酸的混合物首次制得了
和浓盐酸的混合物首次制得了 ,其反应的离子方程式为
,其反应的离子方程式为 反应制得
反应制得 。
。(2)制备
 时,需要先制备
时,需要先制备 ,待
,待 充满装置后再加热盛有硫单质的硬质玻璃管,原因是
充满装置后再加热盛有硫单质的硬质玻璃管,原因是(3)
 溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为
溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为(4)通常采用“酸蒸馏-碘滴定法”测定
 产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水
产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水 作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
①仪器a的名称为
②冷凝管中冷却液需从n管口进入,原因是
 的目的是
的目的是③若四次平行实验,所加样品均为3.00g,消耗0.50mol/L碘标准溶液体积记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(ml) | 0.21 | 0.91 | 0.83 | 0.85 |
| 终点读数(ml) | 22.56 | 20.93 | 20.81 | 20.85 |
a.盛放0.50mol/L碘标准溶液的酸式滴定管未用标准液润洗
b.锥形瓶清洗后未干燥
c.初始时未进行赶气泡操作,有气泡残余,滴定后气泡消失
d.滴定终点读数时俯视读数
e.测定过程中氮气的流速过快
该样品的纯度为
您最近一年使用:0次
8 . CO在工农业生产及科学研究中有着重要应用。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入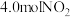 和4.0molCO,在催化制作用下发生反应:
和4.0molCO,在催化制作用下发生反应:
 ,测得相关数据如下:
,测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5min内 的转化率将
的转化率将________ 。(填“变大”、“变小”或“不变”)
②下列表述能说明该反应已达到平衡状态的是________ 。(填序号)
A.CO的消耗反应速率为 消耗反应速率的4倍
消耗反应速率的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中 平衡转化率的条件是
平衡转化率的条件是________ 。(填序号)
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂,Ni的羰化反应为: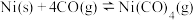
 。
。 温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的 。则:
。则:
①0~10min内平均反应速率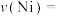
________ g/min。
②研究表明,正反应速率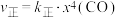 ,逆反应速率
,逆反应速率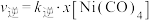 (
( 和
和 分别表示正反应和逆反应的速率常数,x为物质的量分数),计算
分别表示正反应和逆反应的速率常数,x为物质的量分数),计算 温度下的
温度下的
________ 。
(3)已知:
Ⅰ.
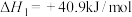
Ⅱ.

由 合成
合成 的热化学方程式为
的热化学方程式为________ 。
如果在不同压强下, 和
和 的起始物质的量比仍为1:3,测定
的起始物质的量比仍为1:3,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示: 的平衡转化率
的平衡转化率 ,
,
 的平衡产率
的平衡产率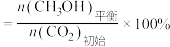 。
。
①压强
________  (填“>”或“<”),原因
(填“>”或“<”),原因________ 。
②其中图中纵坐标表示 平衡转化率的是图
平衡转化率的是图________ (填“甲”或“乙”)。
③图乙中 温度时,两条曲线几乎交于一点,分析原因
温度时,两条曲线几乎交于一点,分析原因________ 。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入
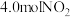 和4.0molCO,在催化制作用下发生反应:
和4.0molCO,在催化制作用下发生反应:
 ,测得相关数据如下:
,测得相关数据如下:时间/min | 0 | 5 | 10 | 15 | 20 |
| 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| 0 | 0.15 | 0.22 | 0.25 | 0.25 |
 的转化率将
的转化率将②下列表述能说明该反应已达到平衡状态的是
A.CO的消耗反应速率为
 消耗反应速率的4倍
消耗反应速率的4倍B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中
 平衡转化率的条件是
平衡转化率的条件是A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂,Ni的羰化反应为:
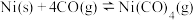
 。
。 温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的 。则:
。则:①0~10min内平均反应速率
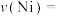
②研究表明,正反应速率
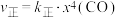 ,逆反应速率
,逆反应速率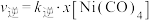 (
( 和
和 分别表示正反应和逆反应的速率常数,x为物质的量分数),计算
分别表示正反应和逆反应的速率常数,x为物质的量分数),计算 温度下的
温度下的
(3)已知:
Ⅰ.

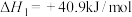
Ⅱ.


由
 合成
合成 的热化学方程式为
的热化学方程式为如果在不同压强下,
 和
和 的起始物质的量比仍为1:3,测定
的起始物质的量比仍为1:3,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示: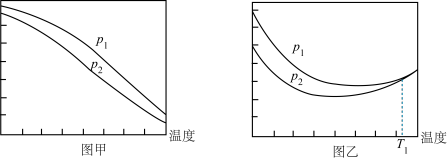
 的平衡转化率
的平衡转化率 ,
, 的平衡产率
的平衡产率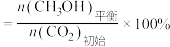 。
。①压强

 (填“>”或“<”),原因
(填“>”或“<”),原因②其中图中纵坐标表示
 平衡转化率的是图
平衡转化率的是图③图乙中
 温度时,两条曲线几乎交于一点,分析原因
温度时,两条曲线几乎交于一点,分析原因
您最近一年使用:0次
9 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用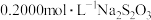 溶液滴定(
溶液滴定(
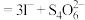 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为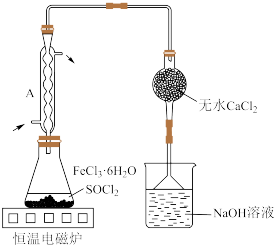
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
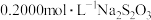 溶液滴定(
溶液滴定(
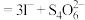 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近一年使用:0次
10 . 锆被称为原子时代的头号金属。一种以氧氯化锆(主要含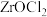 ,还含有少量
,还含有少量 、
、 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为: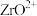 、
、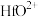 、
、 、
、 ;
;
②25℃时, ,
,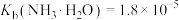 ;
;
回答下列问题:
(1)“酸溶”后, 元素的化合价为
元素的化合价为________ 。
(2)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成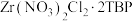 的离子方程式:
的离子方程式:____________________ 。
(3)“沉淀”后,“废液”中 ,则“废液”中
,则“废液”中
________  。
。
(4)“沸腾氯化”时, 转化为
转化为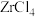 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为____________________ 。
(5)①“还原”的主要目的是____________________ 。
② 沸点远低于
沸点远低于 的可能原因为
的可能原因为____________________ 。
(6)某种掺杂 的
的 晶胞如图所示,
晶胞如图所示, 位于晶胞的面心。
位于晶胞的面心。________ 。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为 ,设
,设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 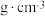 (列出计算式)。
(列出计算式)。
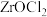 ,还含有少量
,还含有少量 、
、 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下:
①“酸溶”后溶液中各金属元素的存在形式为:
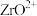 、
、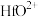 、
、 、
、 ;
;②25℃时,
 ,
,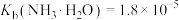 ;
;物质 |
|
|
|
|
|
沸点/℃ | 331 | 315 | 1300 | 700 | 1150 |
(1)“酸溶”后,
 元素的化合价为
元素的化合价为(2)“萃取”时,锆元素可与萃取剂形成多种络合物,写出生成
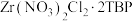 的离子方程式:
的离子方程式:(3)“沉淀”后,“废液”中
 ,则“废液”中
,则“废液”中
 。
。(4)“沸腾氯化”时,
 转化为
转化为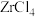 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为(5)①“还原”的主要目的是
②
 沸点远低于
沸点远低于 的可能原因为
的可能原因为(6)某种掺杂
 的
的 晶胞如图所示,
晶胞如图所示, 位于晶胞的面心。
位于晶胞的面心。
②已知该晶胞为立方晶胞,晶胞中O与Zr的最小间距为
 ,设
,设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为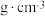 (列出计算式)。
(列出计算式)。③如图所示结构( )与上述晶胞结构不一致的是
)与上述晶胞结构不一致的是
A.  B.
B. C.
C.  D.
D.
您最近一年使用:0次