1 . I.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
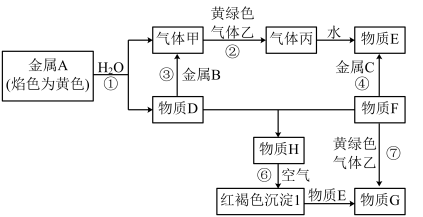
请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:_______ ;
(2)反应③的离子方程式:_______ ;
(3)反应⑦的离子方程式:_______ ;
(4)反应⑥的化学方程式:_______ 。
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
(5)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_______ 的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______ 。

(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
(7)青铜器的主要成分是铜锡合金。崭新的青铜器呈土黄色。当青铜器长期埋在地下,逐渐形成了绿色的铜绿[主要成分Cu2(OH)2CO3],从其化学式可知铜绿是铜与_______ (填物质的化学式)长期作用的结果。

请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:
(2)反应③的离子方程式:
(3)反应⑦的离子方程式:
(4)反应⑥的化学方程式:
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |

(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
| A.20~40℃ | B.60~80℃ | C.230~250℃ | D.300~320℃ |
您最近一年使用:0次
2022-12-07更新
|
116次组卷
|
2卷引用:山西省怀仁市第一中学校云东校区2021-2022学年高一上学期第三次月考理综化学试题
2 . X、Y两种元素是美国的火星探测器“勇气号”从火星采集回来的,科学研究发现,Xn+和Ym-都具有1s22s22p63s23p6的电子层结构,请据此判断关于它们的说法中正确的是
| A.X的原子序数比Y的小 | B.X、Y处于同一周期 |
| C.X的原子半径比Y的原子半径大 | D.Xn+的离子半径比Ym-的离子半径大 |
您最近一年使用:0次
3 . 下列说法错误的是
| A.电子的排布总是遵循“能量最低原理”“泡利原理”和“洪特规则” |
| B.电子排布在同一轨道时,最多只能排2个,且自旋状态必须相反 |
| C.原子核外L层仅有2个电子的X原子与原子核外M层仅有2个电子的Y原子的化学性质一定相似 |
| D.原子发射光谱和吸收光谱的发现,是原子核外电子分层排布的有力证据 |
您最近一年使用:0次
2022-11-03更新
|
276次组卷
|
2卷引用:山西省朔州市怀仁市大地学校2021-2022学年高二上学期第四次月考化学试题
4 . Ⅰ.有两个试管分别装有等浓度的Na2CO3和NaHCO3溶液,
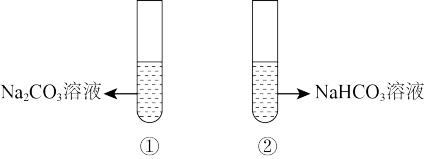
(1)分别加入澄清石灰水,产生沉淀的是_______ ,(填写试管序号,下同。)
(2)逐滴加入等浓度的盐酸,立即产生气泡者的是_______ 。
Ⅱ.铁及其化合物在生产、生活中存在广泛用途。回答下列问题。
(3)可以通过_______ 来鉴别FeCl3溶液和Fe(OH)3胶体;
(4)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质。实验室中检验绿矾晶体是否变质的操作是:_______ 。写出该反应的离子方程式:_______ 。
(5)写铁与水蒸气反应的化学方程式:_______ 。
(6)现将一包铜铁的混合粉末放入盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,该固体不和盐酸反应。关于烧杯中物质组成的说法正确的是_______。(填序号)。

(1)分别加入澄清石灰水,产生沉淀的是
(2)逐滴加入等浓度的盐酸,立即产生气泡者的是
Ⅱ.铁及其化合物在生产、生活中存在广泛用途。回答下列问题。
(3)可以通过
(4)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质。实验室中检验绿矾晶体是否变质的操作是:
(5)写铁与水蒸气反应的化学方程式:
(6)现将一包铜铁的混合粉末放入盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,该固体不和盐酸反应。关于烧杯中物质组成的说法正确的是_______。(填序号)。
| A.溶液中有FeCl2 | B.溶液中含有FeCl2、FeCl3 |
| C.固体中含有铜和铁 | D.溶液中只含FeCl3 |
您最近一年使用:0次
5 . 为了探究新制氯水的性质,设计如下实验:
已知:Cl2+2KI=I2+2KCl,HClO+2KI+HCl=I2+2KCl+H2O。下列推断错误的是
| 操作 | 实验 | R溶液 | 部分实验现象 |
 | ① | 紫色石蕊溶液 | 溶液先变红,后褪色 |
| ② | AgNO3溶液 | 产生白色沉淀 | |
| ③ | KI-淀粉溶液 | 溶液变为蓝色 | |
| ④ | NaHCO3溶液 | 产生气泡 |
| A.实验①中溶液褪色的原因是氯水中含有HCIO |
| B.实验②中白色沉淀是AgCl |
| C.实验③中溶液变为蓝色说明氯水中含有HCl |
| D.实验④中产生气泡说明氯水中含有大量H+ |
您最近一年使用:0次
2022-03-14更新
|
288次组卷
|
2卷引用:山西省晋中市榆次第一中学校2021-2022学年高一上学期12月联合考试化学试卷题
名校
6 . 工业上用电解法制备金属钠和烧碱,化学反应原理如下:
通电反应1:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
通电反应2:2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
下列有关说法错误的是
通电反应1:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑通电反应2:2NaCl(熔融)
 2Na+Cl2↑
2Na+Cl2↑下列有关说法错误的是
| A.制备烧碱的副产物可以用于制盐酸 |
| B.电解2L0.5mol·L-1NaCl溶液最多生成40 g NaOH |
| C.反应1、反应2产生的气体均可以直接排入空气中 |
| D.电解58.5 g NaCl(熔融)最多生成11.2L(已折合成标准状况)Cl2 |
您最近一年使用:0次
解题方法
7 . 利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:
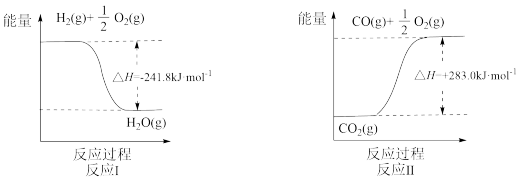
(1)反应Ⅱ是___________ 反应(填“吸热”或“放热”),其原因是___________ 。
(2)反应A的热化学方程式是___________ 。
反应A:

已知:

(1)反应Ⅱ是
(2)反应A的热化学方程式是
您最近一年使用:0次
2022-01-28更新
|
98次组卷
|
2卷引用:山西省晋中市平遥县第二中学2021-2022学年高二上学期12月考试化学试题
名校
解题方法
8 . 工业上,氯气主要用于生产塑料(如PVP)、合成纤维,染料,农药,消毒剂、漂白剂以及各种氯化物。近年来,随着我国经济的快速发展,氯气的需求量迅速增加。某种制备氯气的原理示意图如图。下列说法错误的是


| A.CuO作催化剂且参与了反应 |
| B.反应①②③均为氧化还原反应 |
| C.反应中铜元素的化合价未发生变化 |
D.总反应为 |
您最近一年使用:0次
2022-01-26更新
|
156次组卷
|
4卷引用:山西省晋中市榆次第一中学校2021-2022学年高一上学期12月联合考试化学试卷题
9 . 下列关于“84消毒液”说法不正确的是
| A.在空气中发生反应NaClO+H2O+CO2=NaHCO3+HClO,说明Ka1(H2CO3)>K(HClO) |
| B.“84消毒液”需避光保存的原因是NaClO见光易分解 |
| C.pH越小,“84消毒液”消毒能力越强的原因是HClO氧化性大于ClO- |
| D.不能与双氧水消毒液混用的原因是ClO-+H2O2=Cl-+O2↑+H2O |
您最近一年使用:0次
2022-01-23更新
|
355次组卷
|
3卷引用:山西省临汾新华中学2021-2022学年高一上学期第四次月考化学试题
名校
10 . 半导体器件的研制正式开始于锗(元素符号为Ge),后来发展到研制与它同主族的硅,下列有关锗的叙述不合理的是
| A.锗元素的氧化物化学式为GeO2 |
| B.锗是原子序数为32的一种过渡元素 |
| C.锗在周期表中的位置是第四周期IVA族 |
| D.锗处于周期表中金属与非金属的分界处 |
您最近一年使用:0次
2022-01-23更新
|
495次组卷
|
5卷引用:山西省临汾新华中学2021-2022学年高一上学期第四次月考化学试题



