名校
解题方法
1 . 下列物质中,与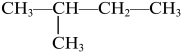 互为同分异构体的是
互为同分异构体的是
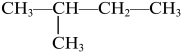 互为同分异构体的是
互为同分异构体的是A. | B.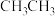 | C.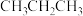 | D.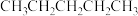 |
您最近一年使用:0次
2023-07-11更新
|
412次组卷
|
9卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题
2 . 下列“实验结论”与“实验操作及现象”相符的一组是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入 溶液,产生白色沉淀 溶液,产生白色沉淀 | 该溶液中一定含有 |
| B | 向某溶液中加入KSCN溶液,溶液变为红色 | 该溶液中一定含有 |
| C | 向某溶液中加入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 该溶液中一定含有 |
| D | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-14更新
|
493次组卷
|
13卷引用:北京市朝阳区2021-2022学年高一年级下学期合格考模拟检测化学试题
北京市朝阳区2021-2022学年高一年级下学期合格考模拟检测化学试题北京景山学校2021-2022学年高一下学期期中考试化学试题北京市第十一中学2021-2022学年高一下学期6月月考化学试题北京市顺义区杨镇第一中学2021-2022学年高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题北京市顺义区第一中学2022-2023学年高一下学期3月月考化学试题天津市南开区2023年普通高中学业水平合格性考试模拟练习化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题云南省红河州弥勒市中小学2018-2019学年高一下学期期末考试化学试题内蒙古集宁一中(西校区)2020—2021学年高一下学期第一次月考化学试题(已下线)专题六 物质的电离与离子反应(已下线)合格考真题汇编22化学实验基础二(已下线)专题二 物质的检验、除杂和鉴别
名校
解题方法
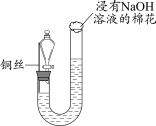
3 . 某小组同学探究影响镁与盐酸反应速率的因素。
【查阅资料】
镁与盐酸反应时,Cl-的浓度对反应速率有影响。
【实验过程】
用下图所示装置(夹持装置已略去,气密性良好)进行三组实验。
【问题与讨论】
(1)向反应器中加入NaCl固体的目的是_______ 。
(2)对比三组实验相同时间段内数据可知:在该实验条件下,Cl-的浓度对镁与盐酸反应速率的影响是_______ 。
(3)镁与盐酸反应的化学方程式是_______ 。
(4)你还想探究影响镁与盐酸反应速率的因素是_______ (写出一条即可)。
【查阅资料】
镁与盐酸反应时,Cl-的浓度对反应速率有影响。
【实验过程】
用下图所示装置(夹持装置已略去,气密性良好)进行三组实验。
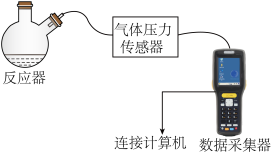
| 加入的n(NaCl)/mol | 6min~7min | 8min~9min | 10min~11min | |
| Δp1/kPa | Δp2/kPa | Δp3/kPa | ||
| 实验Ⅰ | 0.00 | 0.121 | 0.153 | 0.182 |
| 实验Ⅱ | 0.01 | 0.364 | 0.393 | 0.422 |
| 实验Ⅲ | 0.02 | 0.433 | 0.482 | 0.544 |
(1)向反应器中加入NaCl固体的目的是
(2)对比三组实验相同时间段内数据可知:在该实验条件下,Cl-的浓度对镁与盐酸反应速率的影响是
(3)镁与盐酸反应的化学方程式是
(4)你还想探究影响镁与盐酸反应速率的因素是
您最近一年使用:0次
2023-01-17更新
|
194次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
解题方法
4 . 工业上用FeCl3溶液作印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有Fe2+、Cu2+、Fe3+和H+)进行处理,实现FeCl3溶液再生并回收Cu。_______ (填“氧化”或“还原”)为Fe3+。
(2)步骤Ⅱ中发生反应的离子方程式为_______ 。
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加_______ 溶液,有白色沉淀生成,白色沉淀迅速变为灰绿色,最终变为红褐色。
(4)下列说法合理的是_______ (填字母)。
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
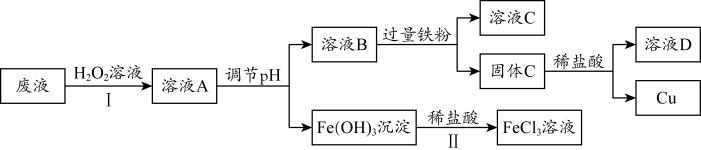
(2)步骤Ⅱ中发生反应的离子方程式为
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加
(4)下列说法合理的是
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
您最近一年使用:0次
名校
解题方法
5 . 一氯化碘(ICl)是一种卤素互化物,与卤素单质性质相似,可用于制农药等。
(1)Cl在元素周期表中位于第三周期、第_______ 族。
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为_______ 价。
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,_______ ,得电子能力Cl强于I。
(4)下列推断中,正确的是_______ (填字母)。
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
(1)Cl在元素周期表中位于第三周期、第
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,
(4)下列推断中,正确的是
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
您最近一年使用:0次
2023-01-17更新
|
273次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
名校
解题方法
6 . 阅读短文,回答问题。
2021年10月16日,我国神舟十三号载人飞船成功将三名航天员送入太空。
我国自主研发、拥有知识产权的高科技新材料为航天事业的发展做出了巨大贡献。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)飞船使用的铝合金材料仅由铝元素组成。(_______)
(2)用于飞船推进舱承力截锥的碳纤维复合材料,具备强度高、承载力大的特点。(_______)
(3)航天员舱内生活用服装体感舒适,采用了高科技康纶纤维材料。(_______)
(4)我国研发的高科技新材料为航天事业的发展做出了巨大贡献。(_______)
2021年10月16日,我国神舟十三号载人飞船成功将三名航天员送入太空。

我国自主研发、拥有知识产权的高科技新材料为航天事业的发展做出了巨大贡献。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)飞船使用的铝合金材料仅由铝元素组成。(_______)
(2)用于飞船推进舱承力截锥的碳纤维复合材料,具备强度高、承载力大的特点。(_______)
(3)航天员舱内生活用服装体感舒适,采用了高科技康纶纤维材料。(_______)
(4)我国研发的高科技新材料为航天事业的发展做出了巨大贡献。(_______)
您最近一年使用:0次
2023-01-17更新
|
174次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
解题方法
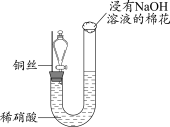
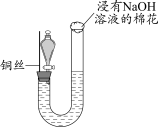
7 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1)HNO3中的氮元素为+5价,是氮元素的最高价态,HNO3具有_______ (填“氧化”或“还原”)性。
(2)步骤III中分液漏斗内的红棕色气体是_______ 。
(3)补全铜与稀硝酸反应的化学方程式:_______ 。_______ (写出一条即可)。
| 步骤I | 步骤II | 步骤III |
|
|
|
| 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
(2)步骤III中分液漏斗内的红棕色气体是
(3)补全铜与稀硝酸反应的化学方程式:
3Cu+8HNO3(稀)=3Cu(NO3)2+ _______↑+4H2O
_______↑+4H2O
您最近一年使用:0次
2023-01-17更新
|
239次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
解题方法
8 . 化学电池的发明,改变了人们的生活。
(1)图所示装置中,Cu片作_______ (填“正极”或“负极”)。
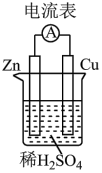
(2)Zn片上发生反应的电极反应式为_______ ;能证明化学能转化为电能的实验现象是_______ 。
(3)常见的锌锰干电池构造示意图如下。
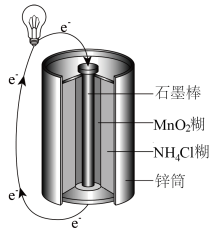
已知:电池的总反应为Zn+2MnO2+2NH =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是_______ (填字母)。
a.锌筒作负极
b.MnO2发生还原反应
(1)图所示装置中,Cu片作

(2)Zn片上发生反应的电极反应式为
(3)常见的锌锰干电池构造示意图如下。

已知:电池的总反应为Zn+2MnO2+2NH
 =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是a.锌筒作负极
b.MnO2发生还原反应
您最近一年使用:0次
名校
解题方法
9 . 汽车尾气系统中安装的催化转化器中,发生如下反应:2CO+2NO N2+2CO2。
N2+2CO2。
(1)作还原剂的物质是_______ ,碳元素的化合价_______ (填“升高”或“降低”)。
(2)若反应中消耗了2molNO,则生成N2的物质的量为_______ mol,转移电子的物质的量为_______ mol。
 N2+2CO2。
N2+2CO2。(1)作还原剂的物质是
(2)若反应中消耗了2molNO,则生成N2的物质的量为
您最近一年使用:0次
2023-01-17更新
|
462次组卷
|
4卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
解题方法
10 . 选择完成下列实验的装置。
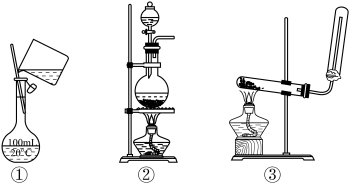
(1)配制100mL1.00mol·L-1NaCl溶液,选用_______ (填序号,下同)。
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,选用_______ 。
(3)加热MnO2和浓盐酸的混合物制Cl2,选用_______ 。

(1)配制100mL1.00mol·L-1NaCl溶液,选用
(2)加热NH4Cl和Ca(OH)2固体混合物制取NH3,选用
(3)加热MnO2和浓盐酸的混合物制Cl2,选用
您最近一年使用:0次