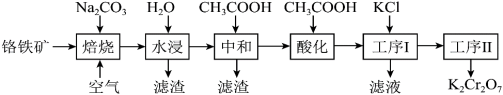
1 . 重铬酸钾(K2Cr2O7)是一种重要的化工原料,可用于制铬矾、火柴、铬颜料,并供鞣革、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,质量分数为67.2%,杂质主要为硅、铁、铝的氧化物]为原料制备重铬酸钾的工艺流程如图所示:
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
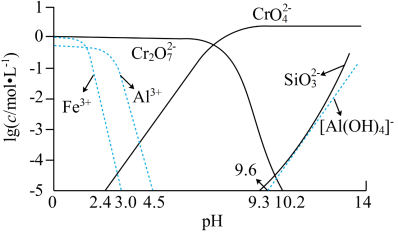
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:______ 。
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:_______ 。
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是_______ (填化学式)。
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:______ 。
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是_______ ,生产过程的产率为______ 。
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为_______ 。(滴定过程中发生的反应为Cr2O +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为
 +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
您最近一年使用:0次
2024-06-03更新
|
132次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
2 . 利用新型合成酶(DHPS)可以设计一种能在较低电压下获得氢气和氧气的电化学装置,如图所示。利用泵将两种参与电极反应的物质进行转移,使物质循环利用,持续工作。下列说法错误的是

A.反应器I中发生的反应为4[Fe(CN)6]3-+2H2O 4[Fe(CN)6]4-+O2↑+4H+ 4[Fe(CN)6]4-+O2↑+4H+ |
| B.隔膜为阴离子交换膜,OH-从电解池的右室通过隔膜向左室迁移 |
| C.电极b与电源的负极相连,电极反应为DHPS+2H2O+2e-=DHPS—2H+2OH- |
D.该装置的总反应为2H2O 2H2↑+O2↑,气体 2H2↑+O2↑,气体 是H2 是H2 |
您最近一年使用:0次
2024-06-01更新
|
94次组卷
|
3卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
3 . 人体血液中存在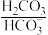 、
、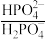 等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示 或
或 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
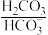 、
、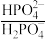 等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示 或
或 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
A.曲线I表示lg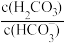 与溶液pH的变化关系 与溶液pH的变化关系 |
| B.Ka1(H2CO3)>Ka2(H3PO4) |
| C.a→b的过程中,水的电离程度逐渐减小 |
D.当pH增大时,lg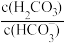 -lg -lg 的值逐渐增大 的值逐渐增大 |
您最近一年使用:0次
2024-05-31更新
|
139次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
4 . 设NA为阿伏加德罗常数的值.下列说法正确的是
| A.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移电子的数目为NA |
| B.25℃、101kPa下,44.8LCO和N2的混合气体中含有的原子数目为4NA |
| C.1molCH3CO18OH与足量乙醇反应生成H218O的数目为NA |
| D.100mLpH=1的CF3COOH溶液中含有H+的数目为0.01NA |
您最近一年使用:0次
2024-05-31更新
|
122次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
解题方法
5 . 一种具有生物活性的药物合成路线中的一步如图所示:

| A.X分子中的C原子一定共面 | B.Y分子中不存在手性碳原子 |
| C.X和Y都能使酸性KMnO4溶液褪色 | D.可以用银氨溶液鉴别X、Y |
您最近一年使用:0次
2024-05-31更新
|
405次组卷
|
3卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
解题方法
6 . W、X、Y、Z为原子序数依次增大的四种短周期元素,A、B、C、D为上述四种元素中的两种或三种所组成的化合物,E为单质,五种物质间的转化关系如图所示。已知室温下,0.1mol•L-1A的水溶液pH为1,B分子中含有10个电子,C为一种盐,D为一种常见的具有漂白性的物质。下列说法正确的是
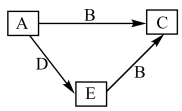
| A.C的溶液显碱性 | B.Z元素在同周期主族元素中原子半径最小 |
| C.X、Y形成的二元化合物只有两种 | D.D中各原子均满足最外层8e-稳定结构 |
您最近一年使用:0次
2024-05-31更新
|
87次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
7 . 中国传统文化源远流长,为世界文明作出巨大贡献。以下对中国传统文化理解正确的是
| A.《本草纲目》记载“盖此矾色绿,味酸,烧之则赤”,“矾”指的是CuSO4•5H2O |
| B.《劝学》中“冰,水为之,而寒于水”,说明冰的能量更高 |
| C.《己亥杂诗》中“落红不是无情物,化作春泥更护花”,蕴含着自然界中的碳、氮循环 |
| D.《杨柳歌》中“独忆飞絮鹅毛下,非复青丝马尾垂”,“飞絮”的化学成分为蛋白质 |
您最近一年使用:0次
2024-05-31更新
|
173次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
名校
8 . 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为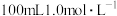 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。
(1)反应过程中能量转化的主要形式:甲为___________ ;乙为___________ 。
(2)以下叙述中,正确的是___________(填字母)。
(3)如图所示为两装置中产生氢气体积随时间的变化图像,其中表示甲的曲线是___________ (填“ ”或“
”或“ ”),若经过5min甲中产生气体体积为224mL(标准状况),下列能够正确表示该反应速率的是
”),若经过5min甲中产生气体体积为224mL(标准状况),下列能够正确表示该反应速率的是___________ (填字母),若要加快甲中反应的速率,可以采取的方法是___________ (任写两种)。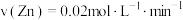 B.
B.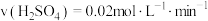
C. D.
D.
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为___________ (填“正极”或“负极”,下同), 离子移向
离子移向___________ , 电极的电极反应式为
电极的电极反应式为___________ ,当外电路中转移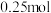 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为___________ g(保留三位小数)。
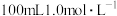 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。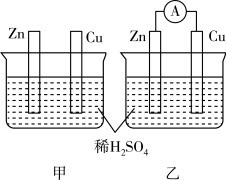
(1)反应过程中能量转化的主要形式:甲为
(2)以下叙述中,正确的是___________(填字母)。
| A.甲中锌片是负极,乙中铜片是正极 | B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 | D.两烧杯中发生的反应相同 |
(3)如图所示为两装置中产生氢气体积随时间的变化图像,其中表示甲的曲线是
 ”或“
”或“ ”),若经过5min甲中产生气体体积为224mL(标准状况),下列能够正确表示该反应速率的是
”),若经过5min甲中产生气体体积为224mL(标准状况),下列能够正确表示该反应速率的是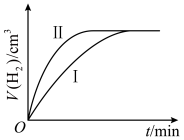
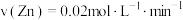 B.
B.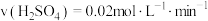
C.
 D.
D.
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为
 离子移向
离子移向 电极的电极反应式为
电极的电极反应式为 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为
您最近一年使用:0次
2024-05-22更新
|
36次组卷
|
3卷引用:陕西省渭南市富平县蓝光中学2023-2024学年高一下学期6月月考化学试题
名校
9 . 某化学兴趣小组在实验室中模拟甲烷与氯气的反应,模拟装置如图所示。
(1)装置A中发生反应的离子方程式为___________ 。
(2)装置B有三种功能:①控制气流速度;②均匀混合气体;③___________ 。
(3)写出装置C中生成物在常温下均为气体的化学方程式:___________ 。
(4)装置D的石棉中均匀混有足量KI粉末,其作用是___________ ,装置C与装置D中发生反应的类型___________ (填“相同”或“不同”)。
(5)装置E中干燥管的作用是___________ ,实验过程中观察到E中有气泡产生,同时有油状液体生成,气泡的主要成分为___________ ,分离出油状液体的最佳方法为___________ 。

(1)装置A中发生反应的离子方程式为
(2)装置B有三种功能:①控制气流速度;②均匀混合气体;③
(3)写出装置C中生成物在常温下均为气体的化学方程式:
(4)装置D的石棉中均匀混有足量KI粉末,其作用是
(5)装置E中干燥管的作用是
您最近一年使用:0次
2024-05-22更新
|
53次组卷
|
4卷引用:陕西省渭南市富平县蓝光中学2023-2024学年高一下学期6月月考化学试题
名校
10 . 电池的充放电效率和续航时间限制了新能源汽车的使用,部分科学家开始将目光投向纸电池。一种纸电池由植入了电极和电解液的纤维素纸构成,其中纤维素纸起到隔离物的作用,电极分别是加入纤维素中的碳纳米管和覆盖在纤维素制成的薄膜上的金属锂,而电解液为六氟磷酸锂溶液。下列说法错误的是
| A.加入纤维素中的碳纳米管为电池的正极 | B.每有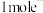 转移,负极质量减轻7g 转移,负极质量减轻7g |
| C.电池放电时六氟磷酸根向锂电极移动 | D.该电池的能量转化效率可以达到100% |
您最近一年使用:0次
2024-05-22更新
|
36次组卷
|
4卷引用:陕西省渭南市富平县蓝光中学2023-2024学年高一下学期6月月考化学试题



