1 . CO2的转化和利用是实现碳中和的有效途径,其中CO2转化为CH3OH被认为是最可能利用的路径,该路径涉及反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
请回答下列问题:
(1)若利用反应I计算反应II的反应热△H2,还需要知道一个化学反应的△H,写出该反应的化学方程式_______ 。
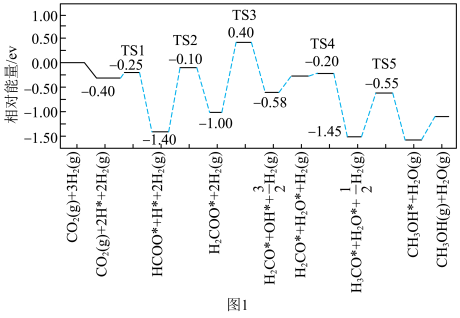
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图1(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ 。
(3)在恒温恒压(260℃,1.8MPa)下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:
i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii.CH3OH的选择性=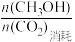 ×100%
×100%
①在普通反应器(A)中,下列能作为反应I和反应II均达到平衡状态的判断判据是_______ (填字母)。
A.气体压强不再变化
B.气体的密度不再改变
C.v正(CO2)=3v逆(H2)
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是_______ ;在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是______ 。
③若反应器(A)中初始时n(CO2)=1mol,反应I从开始到平衡态的平均反应速率v(CH3OH)=_______ mol•s-1;反应II的化学平衡常数Kp(II)=_______ (列出化简后的计算式即可)。
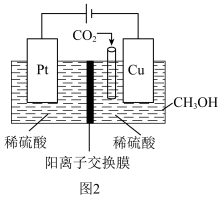
(4)近年来,有研究人员用CO2通过电催化生成CH3OH,实现CO2的回收利用,其工作原理如图2所示,请写出Cu电极上的电极反应:_______ 。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0请回答下列问题:
(1)若利用反应I计算反应II的反应热△H2,还需要知道一个化学反应的△H,写出该反应的化学方程式
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图1(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
(3)在恒温恒压(260℃,1.8MPa)下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
| 反应器 | CO2平衡转化率 | 甲醇的选择性 | 达到平衡时间/s |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | >25.0% | 100.0% | 8.0 |
i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii.CH3OH的选择性=
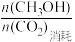 ×100%
×100%①在普通反应器(A)中,下列能作为反应I和反应II均达到平衡状态的判断判据是
A.气体压强不再变化
B.气体的密度不再改变
C.v正(CO2)=3v逆(H2)
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③若反应器(A)中初始时n(CO2)=1mol,反应I从开始到平衡态的平均反应速率v(CH3OH)=
(4)近年来,有研究人员用CO2通过电催化生成CH3OH,实现CO2的回收利用,其工作原理如图2所示,请写出Cu电极上的电极反应:
您最近一年使用:0次
2024-06-06更新
|
117次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
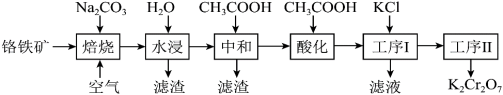
2 . 重铬酸钾(K2Cr2O7)是一种重要的化工原料,可用于制铬矾、火柴、铬颜料,并供鞣革、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,质量分数为67.2%,杂质主要为硅、铁、铝的氧化物]为原料制备重铬酸钾的工艺流程如图所示:
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
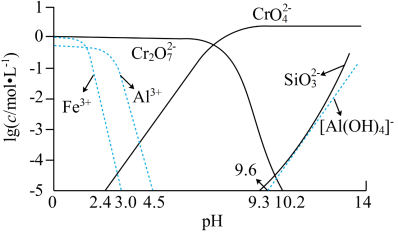
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:______ 。
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:_______ 。
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是_______ (填化学式)。
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:______ 。
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是_______ ,生产过程的产率为______ 。
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为_______ 。(滴定过程中发生的反应为Cr2O +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为
 +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
您最近一年使用:0次
2024-06-03更新
|
129次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
3 . 利用新型合成酶(DHPS)可以设计一种能在较低电压下获得氢气和氧气的电化学装置,如图所示。利用泵将两种参与电极反应的物质进行转移,使物质循环利用,持续工作。下列说法错误的是

A.反应器I中发生的反应为4[Fe(CN)6]3-+2H2O 4[Fe(CN)6]4-+O2↑+4H+ 4[Fe(CN)6]4-+O2↑+4H+ |
| B.隔膜为阴离子交换膜,OH-从电解池的右室通过隔膜向左室迁移 |
| C.电极b与电源的负极相连,电极反应为DHPS+2H2O+2e-=DHPS—2H+2OH- |
D.该装置的总反应为2H2O 2H2↑+O2↑,气体 2H2↑+O2↑,气体 是H2 是H2 |
您最近一年使用:0次
2024-06-01更新
|
90次组卷
|
3卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
4 . 人体血液中存在 、
、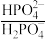 等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示 或
或 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
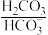 、
、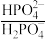 等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中部分缓冲对的微粒浓度之比的对数值lgx[x表示 或
或 与溶液pH的关系如图所示。下列说法错误的是
与溶液pH的关系如图所示。下列说法错误的是
A.曲线I表示lg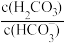 与溶液pH的变化关系 与溶液pH的变化关系 |
| B.Ka1(H2CO3)>Ka2(H3PO4) |
| C.a→b的过程中,水的电离程度逐渐减小 |
D.当pH增大时,lg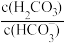 -lg -lg 的值逐渐增大 的值逐渐增大 |
您最近一年使用:0次
2024-05-31更新
|
134次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
5 . 设NA为阿伏加德罗常数的值.下列说法正确的是
| A.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移电子的数目为NA |
| B.25℃、101kPa下,44.8LCO和N2的混合气体中含有的原子数目为4NA |
| C.1molCH3CO18OH与足量乙醇反应生成H218O的数目为NA |
| D.100mLpH=1的CF3COOH溶液中含有H+的数目为0.01NA |
您最近一年使用:0次
2024-05-31更新
|
122次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
解题方法
6 . 一种具有生物活性的药物合成路线中的一步如图所示:

| A.X分子中的C原子一定共面 | B.Y分子中不存在手性碳原子 |
| C.X和Y都能使酸性KMnO4溶液褪色 | D.可以用银氨溶液鉴别X、Y |
您最近一年使用:0次
2024-05-31更新
|
397次组卷
|
3卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
解题方法
7 . W、X、Y、Z为原子序数依次增大的四种短周期元素,A、B、C、D为上述四种元素中的两种或三种所组成的化合物,E为单质,五种物质间的转化关系如图所示。已知室温下,0.1mol•L-1A的水溶液pH为1,B分子中含有10个电子,C为一种盐,D为一种常见的具有漂白性的物质。下列说法正确的是
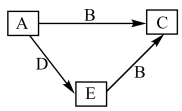
| A.C的溶液显碱性 | B.Z元素在同周期主族元素中原子半径最小 |
| C.X、Y形成的二元化合物只有两种 | D.D中各原子均满足最外层8e-稳定结构 |
您最近一年使用:0次
2024-05-31更新
|
85次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
8 . 中国传统文化源远流长,为世界文明作出巨大贡献。以下对中国传统文化理解正确的是
| A.《本草纲目》记载“盖此矾色绿,味酸,烧之则赤”,“矾”指的是CuSO4•5H2O |
| B.《劝学》中“冰,水为之,而寒于水”,说明冰的能量更高 |
| C.《己亥杂诗》中“落红不是无情物,化作春泥更护花”,蕴含着自然界中的碳、氮循环 |
| D.《杨柳歌》中“独忆飞絮鹅毛下,非复青丝马尾垂”,“飞絮”的化学成分为蛋白质 |
您最近一年使用:0次
2024-05-31更新
|
161次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
9 . 随着社会的不断发展,生活水平的提高,人们越来越关注健康。有机物K是合成某重要药物的中间体,其合成路线如图:
①E、F与新制氢氧化铜悬浊液共热都产生砖红色沉淀。
(1)A所含官能团的名称为_______ ;C的名称是______ 。
(2)C+I→J的反应类型是______ 。
(3)F的结构简式为_______ ,K的结构简式为_______ 。
(4)G与银氨溶液发生反应的化学方程式为_______ 。
(5)I的同系物M的分子式为C6H10O4,满足以下两个条件的M的同分异构体有_______ 种(不考虑立体异构)。
①可以与碳酸氢钠反应产生气体;
②可以水解且能与银氨溶液发生银镜反应.
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的结构简式为_______ (写出其中一种即可)。
(6)以丙二酸(HOOCCH2COOH)、乙烯为原料合成2—乙基丁酸(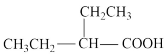 ),设计合成路线:
),设计合成路线:______ (其他试剂任选)。
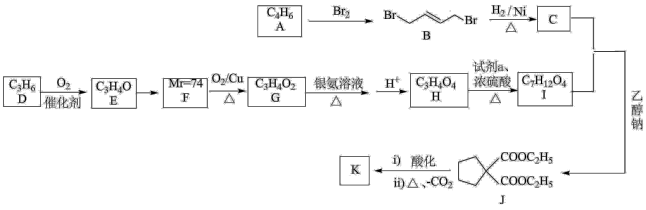
①E、F与新制氢氧化铜悬浊液共热都产生砖红色沉淀。
②

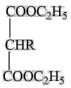
 RCH2COOH(R表示烃基,X表示卤素原子)
RCH2COOH(R表示烃基,X表示卤素原子)
(1)A所含官能团的名称为
(2)C+I→J的反应类型是
(3)F的结构简式为
(4)G与银氨溶液发生反应的化学方程式为
(5)I的同系物M的分子式为C6H10O4,满足以下两个条件的M的同分异构体有
①可以与碳酸氢钠反应产生气体;
②可以水解且能与银氨溶液发生银镜反应.
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的结构简式为
(6)以丙二酸(HOOCCH2COOH)、乙烯为原料合成2—乙基丁酸(
 ),设计合成路线:
),设计合成路线:
您最近一年使用:0次
2024-05-12更新
|
200次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
名校
解题方法
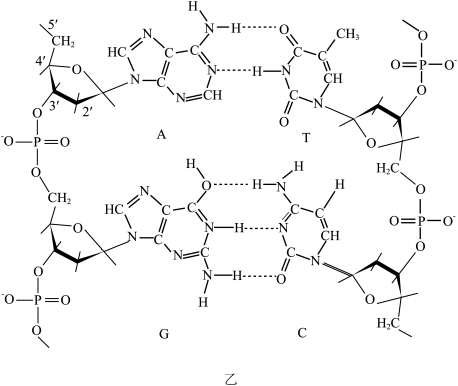
10 . 回答下列问题。
(1)硼的研究在无机化学发展中占有独特的位置。硼元素有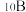 和
和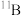 两种天然稳定的同位素,在基态
两种天然稳定的同位素,在基态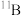 原子中,核外存在
原子中,核外存在___________ 对自旋相反的电子,有___________ 种不同空间运动状态的电子,根据对角线规则,硼元素许多性质与___________ 元素相似。
(2)在 分子中,
分子中, 的键角是
的键角是___________ 。
(3)O和S两种元素是自然界最常见的两种元素。均能与H形成 和
和 ,结构如图甲所示。请说明∠H—O—O(97°)略大于∠H-S-S(95°)的原因:
,结构如图甲所示。请说明∠H—O—O(97°)略大于∠H-S-S(95°)的原因:___________ 。___________ ;___________ 。
(1)硼的研究在无机化学发展中占有独特的位置。硼元素有
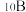 和
和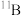 两种天然稳定的同位素,在基态
两种天然稳定的同位素,在基态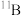 原子中,核外存在
原子中,核外存在(2)在
 分子中,
分子中, 的键角是
的键角是(3)O和S两种元素是自然界最常见的两种元素。均能与H形成
 和
和 ,结构如图甲所示。请说明∠H—O—O(97°)略大于∠H-S-S(95°)的原因:
,结构如图甲所示。请说明∠H—O—O(97°)略大于∠H-S-S(95°)的原因: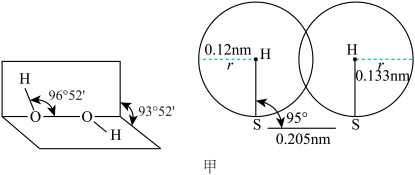
您最近一年使用:0次



