名校
解题方法
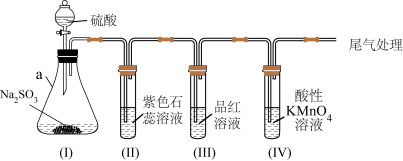
1 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次
2 . 小组同学探究 与水的反应。
与水的反应。
在注射器中充入 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。_______ 。
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ. 与水反应:
与水反应: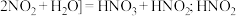 不稳定,分解产生气体。
不稳定,分解产生气体。
ⅱ. 能与KI反应生成
能与KI反应生成 。
。
【提出猜想】溶液A中含有 。
。
【进行实验】
①实验Ⅰ的目的是_______ 。
②实验Ⅱ中选择 溶液的依据是
溶液的依据是_______ (填字母)。
a. 具有氧化性,
具有氧化性, 具有还原性
具有还原性
b. 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化
③甲同学认为,实验Ⅲ不能证明溶液A中含有 ,理由是
,理由是_______ 。
【实验反思】
本实验条件下, 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
 与水的反应。
与水的反应。在注射器中充入
 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。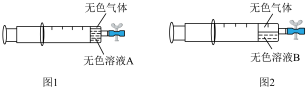
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ.
 与水反应:
与水反应: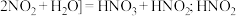 不稳定,分解产生气体。
不稳定,分解产生气体。ⅱ.
 能与KI反应生成
能与KI反应生成 。
。【提出猜想】溶液A中含有
 。
。【进行实验】
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 |
|
|
|
实验现象 | 液体颜色变为浅红色 | 溶液颜色仍为无色 | 溶液颜色变为蓝色 |
②实验Ⅱ中选择
 溶液的依据是
溶液的依据是a.
 具有氧化性,
具有氧化性, 具有还原性
具有还原性b.
 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化③甲同学认为,实验Ⅲ不能证明溶液A中含有
 ,理由是
,理由是【实验反思】
本实验条件下,
 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
您最近一年使用:0次
3 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
4 . 铁是重要的常见金属材料,也是人类较早使用的金属之一。完成下列问题:
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入氧化铁和铝粉的混合物,用镁条引燃发生反应,配平其化学方程式: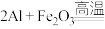
______ 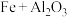 。
。
(2)向20 mL的沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至观察到透明的红褐色。此分散系分散质中粒子直径的范围是______ (填“<1”或“1~100”)nm。
(3)电子工业上常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。上述事实利用了FeCl3溶液的______ (填“氧化性”或“还原性”)。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入氧化铁和铝粉的混合物,用镁条引燃发生反应,配平其化学方程式:
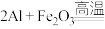
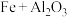 。
。(2)向20 mL的沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至观察到透明的红褐色。此分散系分散质中粒子直径的范围是
(3)电子工业上常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。上述事实利用了FeCl3溶液的
您最近一年使用:0次
5 . 向 溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,该实验现象说明
溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,该实验现象说明
 溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,该实验现象说明
溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,该实验现象说明A. 具有氧化性 具有氧化性 | B. 具有氧化性 具有氧化性 | C. 具有氧化性 具有氧化性 | D. 具有还原性 具有还原性 |
您最近一年使用:0次
解题方法
6 . 下列有关物质性质与用途对应关系不正确 的是
| A.Na2CO3溶液呈碱性,可用除油污 | B.明矾易溶于水,可用作净水剂 |
| C.ClO2具有强氧化性,可用作消毒剂 | D.FeCl3具有氧化性,可用于蚀刻电路板 |
您最近一年使用:0次
解题方法
7 . 如图是元素周期表中的一部分。
(1)化学性质最不活泼的元素是_________ ,氧化性最强的单质是__________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是_________ ,呈两性的是_________ 。
(3)在B、C、D、G、I中,原子半径最大的是_________ ,它们的离子半径最大是_________ (填离子符号)。
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为___________________ 。
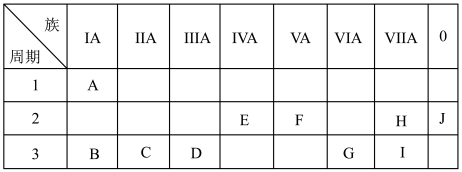
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)在B、C、D、G、I中,原子半径最大的是
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 对下列家务劳动所涉及原理的解释不正确的是
| 选项 | 家务劳动 | 化学知识 |
| A | 餐后将铁锅洗净后擦干 | Fe在潮湿的空气中易生锈 |
| B | 使用白醋除去水壶中的水垢 | 白醋可与CaCO3、Mg(OH)2反应 |
| C | 使用“84”消毒液(主要成分为NaClO、NaCl)进行环境消毒 | NaCl具有强氧化性 |
| D | 用温热的纯碱溶液清洗油污 | 油脂在碱性条件下可发生水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-29更新
|
308次组卷
|
3卷引用:2024年江苏省靖江高级中学学业水平合格性考试化学试题
名校
解题方法
9 . 某化学兴趣小组设计如图实验装置(夹持装置已省略),探究 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是__________ 。
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。
①装置A中制备 的离子方程式为
的离子方程式为__________ 。
②证明 的氧化性大于
的氧化性大于 的现象是
的现象是__________ 。
③装置C的作用是__________ ,装置D中所盛试剂为__________ (填化学式)溶液。
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。
① 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
②实验完成后,打开弹簧夹,持续通入 的目的是
的目的是__________ 。
(4)淀粉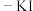 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉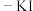 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(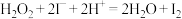 ,
, )。
)。
①滴定终点现象是__________ 。
②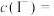
__________  。
。
 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞
 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。①装置A中制备
 的离子方程式为
的离子方程式为②证明
 的氧化性大于
的氧化性大于 的现象是
的现象是③装置C的作用是
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞
 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。①
 发生反应的化学方程式为
发生反应的化学方程式为②实验完成后,打开弹簧夹,持续通入
 的目的是
的目的是(4)淀粉
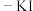 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(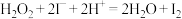 ,
, )。
)。①滴定终点现象是
②
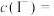
 。
。
您最近一年使用:0次
2024-04-10更新
|
199次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
10 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将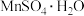 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用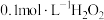 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为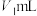 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中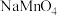 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,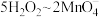 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: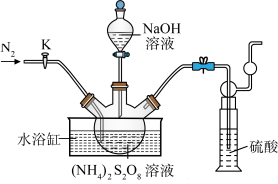
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将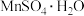 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
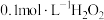 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为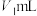 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中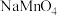 的质量为
的质量为 的代数式表示,
的代数式表示,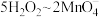 )
)
您最近一年使用:0次