1 . 某实验小组欲通过加热蒸发KNO3溶液的方法获得KNO3固体。已知KNO3固体在一定温度下能够发生反应:2KNO3 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】
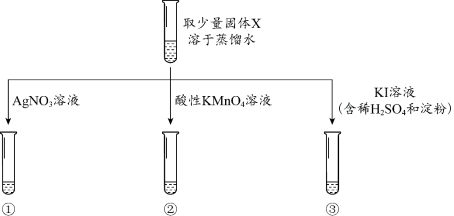
【分析解释】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是_______ 。
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +_______ + 3H2O
(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是_______ (填字母)。
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是_______ 。
 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】

【分析解释】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO
 + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是
您最近一年使用:0次
2022-04-15更新
|
290次组卷
|
2卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题
名校
2 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
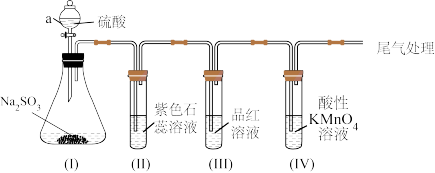
【实验探究】
(1)装置(I)仪器a的名称是___ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为____ ,原因是SO2和水反应生成____ (填“H2SO3”或“H2SO4”)。
②装置(III)中品红溶液褪色,原因是____ 。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用____ (填“NaOH溶液”或“稀硫酸”)吸收。
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现____ (填“白色”或“淡黄色”)浑浊,补充完整下面的离子方程式:____ 。
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和____ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液褪色,原因是
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g•kg-1 | 0.25g•kg-1 | 1g•kg-1 |
您最近一年使用:0次
2022-07-11更新
|
403次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
3 . 食醋可以清除水壶中的少量水垢(主要成分是CaCO3),这是利用了醋酸的
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
2022-12-14更新
|
660次组卷
|
4卷引用:黑龙江省2022年7月学业水平合格考试化学试题
黑龙江省2022年7月学业水平合格考试化学试题(已下线)专题09 羧酸和羧酸衍生物(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)黑龙江省大庆实验中学二部2022-2023学年高一下学期期中考试(文科)化学试题新疆生产建设兵团第二师八一中学2022-2023学年高一下学期期末考试化学试题
名校
4 . 下表列出了①-⑤五种元素在周期表中的位置:
按要求回答下列问题:
(1)元素⑥的最高正化合价是___________ ,最低负化合价是___________ 。
(2)元素⑤在周期表中的位置是___________ 。
(3)元素②和元素③的非金属性强弱关系是②___________ ③(选“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是___________ (填化学式)。
(4)①~⑥六种元素中原子半径最大的是___________ (填元素符号)。②③两种元素的最简单氢化物中最稳定 的是___________ (填化学式)
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:___________ 。
(6)CH4与NH3相比,热稳定性较强的是___________ ;Cl2和N2氧化性较强的是___________ 。
(7)碳的一种氢化物结构式为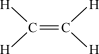 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比m(C):m(H)___________ 。(相对原子质量:C-12,C-H)
(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | ⅢA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ |
(1)元素⑥的最高正化合价是
(2)元素⑤在周期表中的位置是
(3)元素②和元素③的非金属性强弱关系是②
(4)①~⑥六种元素中原子半径最大的是
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:
(6)CH4与NH3相比,热稳定性较强的是
(7)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
| A.还原性:Na<Mg | B.非金属性:O>S |
| C.酸性:H2S>HCl | D.碱性:NaOH>Al(OH)3 |
您最近一年使用:0次
2022-06-09更新
|
334次组卷
|
3卷引用:福建省三明市第二中学2021-2022学年高一下学期会考模拟卷(一)化学试题
5 . 化学实验是研究和学习物质及其变化的基本方法,是科学探究的一种重要途径。浓硫酸与木炭在加热条件下可发生化学反应: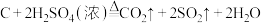 。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
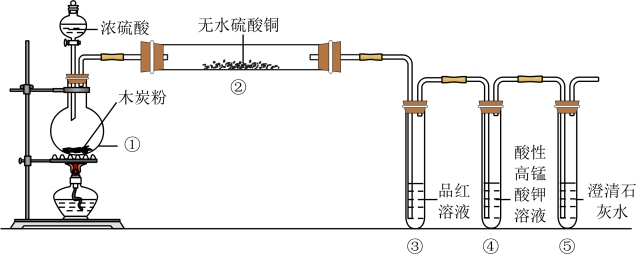
(1)装置中仪器①的名称是
(2)在浓硫酸与木炭的反应中,硫元素化合价的变化是
(3)装置②中的实验现象是白色粉末变蓝,这证明了产物中有
(4)装置③中的实验现象是品红溶液褪色,体现了二氧化硫的性质是
(5)装置④中酸性高锰酸钾溶液的作用是
(6)装置⑤中可观察到的实验现象是
 。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
。为检验反应的产物,设计了如下图所示的实验。请基于实验事实回答下列问题:
(1)装置中仪器①的名称是
| A.锥形瓶 | B.圆底烧瓶 | C.酒精灯 | D.分液漏斗 |
| A.升高 | B.降低 | C.不变 | D.无法判断 |
A. | B. | C. | D. 和 和 |
| A.酸性 | B.还原性 | C.氧化性 | D.漂白性 |
A.吸收 | B.吸收 | C.吸收 | D.检验 |
| A.澄清石灰水变蓝 | B.澄清石灰水变红 | C.澄清石灰水变浑浊 | D.澄清石灰水无现象 |
您最近一年使用:0次
10-11高三上·福建莆田·期中
解题方法
6 . 某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1—2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_______ (填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_______ 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为_______
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______ (填离子的化学式)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_______ 。
(1)提出问题:Fe3+、Br2,谁的氧化性更强。
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
您最近一年使用:0次
2019-01-30更新
|
450次组卷
|
7卷引用:上海市长宁区2022-2023学年高一上学期学业综合评价化学试题
上海市长宁区2022-2023学年高一上学期学业综合评价化学试题(已下线)2011届福建省莆田一中高三上学期期中考试化学试卷(已下线)2012届福建省莆田一中高三第一学段考试化学试卷(已下线)2015届河南郑州市第四十七中学高三上第一次(10月)月考化学试卷(已下线)2014届浙江省衢州第二中学高三上学期期中考试化学试卷2016届河南省周口中英文学校高三上学期期中测试化学试卷(已下线)专题九 铁及其化合物
7 . 无机物A~C在一定条件下的转化关系如图所示,A为淡黄色的固体化合物,B是地壳中含量最多的金属元素的单质,请回答下列问题:
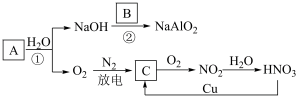
(1)写出A的化学式______ ,C的化学式______ 。
(2)写出稀HNO3与Cu反应生成C的离子方程式________ ;在该反应中,HNO3表现出酸性和强______ (填“氧化性”或“还原性”)。
(3)写出反应②的化学方程式________ 。

(1)写出A的化学式
(2)写出稀HNO3与Cu反应生成C的离子方程式
(3)写出反应②的化学方程式
您最近一年使用:0次
8 . 天然气中常混有 ,现用如下方法测定天然气中
,现用如下方法测定天然气中 的含量。反应中涉及的方程式有:
的含量。反应中涉及的方程式有:
①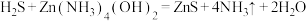
②
③
(1)反应①中, 体现
体现_______ (选填“酸性”“氧化性”或“还原性”)。
采用以下方法测定 的含量。
的含量。
步骤I:将1L天然气中的 溶于水并进行反应①,配制成500mL溶液。
溶于水并进行反应①,配制成500mL溶液。
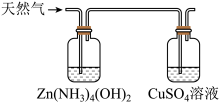
步骤II:加入0.001mol的I2(过量)使ZnS完全转化为ZnI2,加入淀粉溶液作为指示剂,用0.1mol·L-1的 滴定过量的I2,做几组平行实验,平均消耗15.00mL。
滴定过量的I2,做几组平行实验,平均消耗15.00mL。
(2)①滴定达到终点的现象为:溶液由_______ 色变_______ 色,且半分钟不恢复原色。
②根据条件计算天然气中H2S的含量为_______ mg·L-1。
③若在步骤I收集H2S的过程中,有少量硫化氢进入 溶液中,则测得H2S的含量
溶液中,则测得H2S的含量_______ (选填“偏高”“偏低”或“无影响”)。
(3)假设在反应②中,碘单质全部转化为易溶于水的ZnI2,如何检验体系中的I-_______ 。
(4)利用硫碘循环处理H2S的方法如图所示:
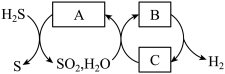
写出上述流程中A、B、C的化学式。
A:_______ ;B:_______ ;C:_______ 。
 ,现用如下方法测定天然气中
,现用如下方法测定天然气中 的含量。反应中涉及的方程式有:
的含量。反应中涉及的方程式有:①
②

③

(1)反应①中,
 体现
体现采用以下方法测定
 的含量。
的含量。步骤I:将1L天然气中的
 溶于水并进行反应①,配制成500mL溶液。
溶于水并进行反应①,配制成500mL溶液。
步骤II:加入0.001mol的I2(过量)使ZnS完全转化为ZnI2,加入淀粉溶液作为指示剂,用0.1mol·L-1的
 滴定过量的I2,做几组平行实验,平均消耗15.00mL。
滴定过量的I2,做几组平行实验,平均消耗15.00mL。(2)①滴定达到终点的现象为:溶液由
②根据条件计算天然气中H2S的含量为
③若在步骤I收集H2S的过程中,有少量硫化氢进入
 溶液中,则测得H2S的含量
溶液中,则测得H2S的含量(3)假设在反应②中,碘单质全部转化为易溶于水的ZnI2,如何检验体系中的I-
(4)利用硫碘循环处理H2S的方法如图所示:

写出上述流程中A、B、C的化学式。
A:
您最近一年使用:0次
名校
9 . 利用如图可以从不同角度研究含硫物质的性质及其转化关系。
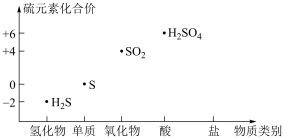
回答下列问题:
(1)H2S与SO2反应的化学方程式为____ ,反应中H2S体现____ (填“氧化性”或“还原性”)。
(2)加热时,浓硫酸与木炭反应的化学方程式为____ ,下列试剂不能用于验证生成物中含有SO2的是____ (填标号)。
a.品红溶液b.酸性KMnO4溶液c.澄清石灰水
(3)SO2的过度排放会引起酸雨,酸雨是指pH<____ 的雨水,其中NOx的排放也会导致酸雨的形成,写出NO2与水反应的化学方程式____ 。
(4)实验室可用碱液吸收法对NOx进行尾气处理,写出NO2与氢氧化钠溶液反应的离子方程式____ 。

回答下列问题:
(1)H2S与SO2反应的化学方程式为
(2)加热时,浓硫酸与木炭反应的化学方程式为
a.品红溶液b.酸性KMnO4溶液c.澄清石灰水
(3)SO2的过度排放会引起酸雨,酸雨是指pH<
(4)实验室可用碱液吸收法对NOx进行尾气处理,写出NO2与氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
10 . 某小组同学利用以下实验装置研究SO2的性质(经检验,装置的气密性良好)。
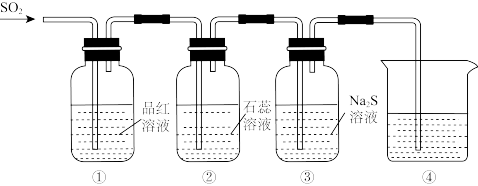
(1)①中的现象是_______ 。
(2)②中石蕊溶液变红,说明SO2与H2O反应生成了酸性物质。写出该反应的化学方程式:_______ 。
(3)③中产生淡黄色浑浊,体现了SO2的_______ (填字母)。
a.氧化性 b.还原性
(4)④用于吸收多余的SO2,可选用的试剂是_______ 。

(1)①中的现象是
(2)②中石蕊溶液变红,说明SO2与H2O反应生成了酸性物质。写出该反应的化学方程式:
(3)③中产生淡黄色浑浊,体现了SO2的
a.氧化性 b.还原性
(4)④用于吸收多余的SO2,可选用的试剂是
您最近一年使用:0次
2022-04-15更新
|
227次组卷
|
3卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题



