1 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: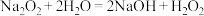 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: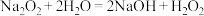 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
名校
解题方法
2 . 亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近一年使用:0次
2022-07-12更新
|
335次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
名校
解题方法
3 . 乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知A装置可产生乙烯气体)。
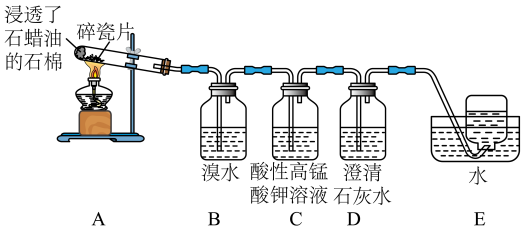
(1)乙烯的电子式为___________ ,其分子空间结构为___________
(2)用化学方程式解释B装置中的实验现象:___________ 。
(3)C装置中的现象是___________ ,其发生反应的反应类型是___________ 。
(4)查阅资料可知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳,则除去甲烷中乙烯的方法是___________
(5)工业上利用乙烯水化制备乙醇,其对应的化学方程式为___________ ;反应类型为___________

(1)乙烯的电子式为
(2)用化学方程式解释B装置中的实验现象:
(3)C装置中的现象是
(4)查阅资料可知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳,则除去甲烷中乙烯的方法是___________
| A.将气体通入水中 | B.将气体通过装溴水的洗气瓶 |
| C.将气体通过装酸性高锰酸钾溶液的洗气瓶 | D.将气体通入氢氧化钠溶液中 |
您最近一年使用:0次
2022-05-16更新
|
944次组卷
|
3卷引用:甘肃省武威第七中学2021-2022学年高一下学期学科竞赛化学试题
4 . 下列有关物质的性质与用途具有对应关系的是
| A.晶体硅硬度大,可用于制作半导体材料 |
| B.二氧化硅难溶于水,可用于制作光导纤维 |
| C.二氧化氯具有强氧化性,可用作自来水消毒剂 |
| D.氨气具有还原性,可用作制冷剂 |
您最近一年使用:0次
5 . 完成下列问题
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号) 和
和 从大到小排序:
从大到小排序:_________


_________ _________ _________ _________ _________
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号)
①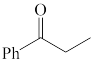

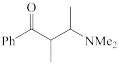
②


③

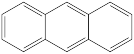
④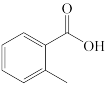


 和
和 从大到小排序:
从大到小排序:



(a)  (b)
(b) 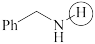 (c)
(c) 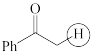 (d)
(d) 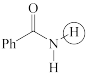 (e)
(e) 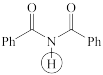
A. B.
B. C.
C.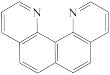 D.
D.
A.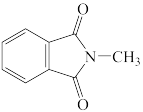 B.
B. C.
C. D.
D.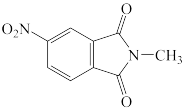
A. 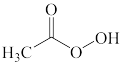 B.
B. 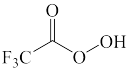 C.
C. 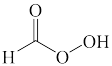 D.
D.  E.
E.  F.
F. 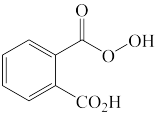
①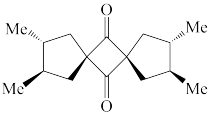 ②
② ③
③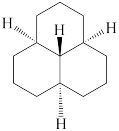 ④
④ ⑤
⑤
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
您最近一年使用:0次
6 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
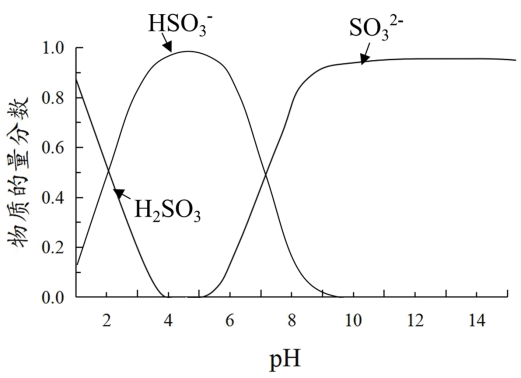
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1805次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题天天练6-10
名校
解题方法
7 . 一种农业常用肥料的结构如图所示,其中X、Y、Z、W为核电荷数依次增大的前20号主族元素,且位于不同周期,该物质的水溶液显酸性。
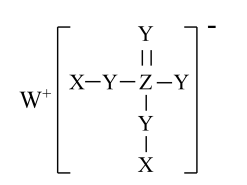
下列说法正确的是
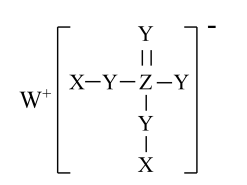
下列说法正确的是
| A.离子化合物WX具有强氧化性 |
B.该物质的水溶液中: c(X3ZY4)>c(XZY ) ) |
| C.Z的简单气态氢化物的热稳定性比Y的强 |
| D.Y与其他三种元素均可形成两种或两种以上的二元化合物 |
您最近一年使用:0次
2022-02-28更新
|
258次组卷
|
3卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题(已下线)卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)四川省成都市郫都区2021-2022学年高三第三次阶段考试理科综合化学试题
名校
解题方法
8 . 铜是生活中常见的金属,以铜为原料进行如下实验。回答下列问题:
Ⅰ.制备
(1)利用铜与浓硫酸制备 ,适宜的装置是
,适宜的装置是_______ (从A、B、C中选择),该装置内发生的化学方程式为_______ 。
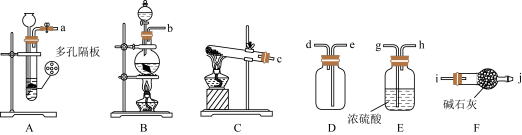
(2)收集干燥的 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→_______ (填小写字母)。
(3)反应后,发生装置中未观察到蓝色溶液,原因是_______ 。
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。
(4)写出生成 的离子方程式
的离子方程式_______ 。
(5)学习小组提出猜想:升高温度, 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。
①小组同学认为实验1~3的结果,不能证明猜想成立,理由是_______ 。
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)_______ 。小组同学结合实验1~6,判断猜想成立,依据是_______ 。
Ⅰ.制备

(1)利用铜与浓硫酸制备
 ,适宜的装置是
,适宜的装置是
(2)收集干燥的
 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→(3)反应后,发生装置中未观察到蓝色溶液,原因是
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的
 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。(4)写出生成
 的离子方程式
的离子方程式(5)学习小组提出猜想:升高温度,
 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。| 实验序号 | 30%H2O2(mL) | 1mol/LCuSO4(mL) | 水(mL) | 水浴温度(℃) | 3min时生成O2的平均速率(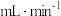 ) ) |
| 1 | 10 | 1 | 1 | 20 | 2.4 |
| 2 | 10 | 1 | 1 | 30 | 9 |
| 3 | 10 | 1 | 1 | 40 | 90 |
| 4 | 10 | 0 | 2 | 20 | A1 |
| 5 | A2 | ||||
| 6 | 10 | 0 | 2 | 40 | A3 |
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)
您最近一年使用:0次
2022-04-15更新
|
1536次组卷
|
9卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题甘肃省兰州市外国语高级中学2022-2023学年高三上学期第二次考试化学试题湖南省湘潭市第一中学2023届高三上学期第五次月考化学试题广东省广州市玉岩中学2024届高三上学期10月月考化学试题
名校
解题方法
9 . 钠是活泼金属,受热后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体——过氧化钠,由于空气中还有其它成分,因此可能还有一些同时发生的其它反应”。某校化学兴趣小组同学据此进行了有关探究。
【猜想】钠在空气中燃烧,生成过氧化钠、氧化钠,还有氮化钠。
【查阅资料】氮化钠与水反应能生成氢氧化钠和氨气。
【实验】①取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠燃烧;
②将燃烧产物投入水中,得到0.224L(折算成标准状态)气体和1000mL溶液;
③经检验,该气体为纯净的氧气;
④从1000mL溶液中取出25.00mL溶液,加入1.00mol·L-1HCl溶液至13.50mL时恰好完全反应。
【结论】
(1)通过计算确定钠的燃烧产物中是否含有氮化钠___________ 。
(2)计算钠在空气中燃烧产物中各成分的物质的量之比___________ 。
【猜想】钠在空气中燃烧,生成过氧化钠、氧化钠,还有氮化钠。
【查阅资料】氮化钠与水反应能生成氢氧化钠和氨气。
【实验】①取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠燃烧;
②将燃烧产物投入水中,得到0.224L(折算成标准状态)气体和1000mL溶液;
③经检验,该气体为纯净的氧气;
④从1000mL溶液中取出25.00mL溶液,加入1.00mol·L-1HCl溶液至13.50mL时恰好完全反应。
【结论】
(1)通过计算确定钠的燃烧产物中是否含有氮化钠
(2)计算钠在空气中燃烧产物中各成分的物质的量之比
您最近一年使用:0次
2022-09-22更新
|
467次组卷
|
2卷引用:浙江省温州市苍南县2022年第十六届“求知杯”高一化学竞赛试题
名校
解题方法
10 . 已知 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,
, 、
、 、
、 、
、 的氧化性依次减弱。下列反应在水溶液中不可能发生的是
的氧化性依次减弱。下列反应在水溶液中不可能发生的是
 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,
, 、
、 、
、 、
、 的氧化性依次减弱。下列反应在水溶液中不可能发生的是
的氧化性依次减弱。下列反应在水溶液中不可能发生的是A.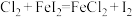 |
B.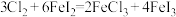 |
C.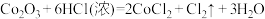 |
D.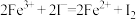 |
您最近一年使用:0次
2023-12-06更新
|
188次组卷
|
62卷引用:陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题
陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题河南省商丘市高级中学2021-2022学年高一上学期期末考试暨学学考试化学试题湖北省问津联合体2021-2022学年高一下学期5月质量检测化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)江西省丰城市第九中学(日新班)2021-2022学年高一下学期期末检测化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题陕西省榆林市定边四中2023届高三上学期第一次月考化学试题(已下线)第一章 物质及其变化(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 陕西省咸阳市武功县普集高级中学2022-2023学年高一上学期第一次月考化学试题河北省石家庄市第二中学2022-2023学年高一上学期10月月考化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期第一次月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题安徽省皖北地区2022-2023学年高一上学期期末联考化学试题北京市第一六一中学2022-2023学年高一上学期12月月考化学试题福建省厦门第六中学2019-2020学年高一下学期3月月考化学试题(已下线)【浙江新东方】6广东省东莞市东华高级中学2020-2021学年高一上学期第一次月考化学试题广东省深圳外国语学校2021届高三第二次月考化学试题云南省保山市第九中学2021届高三上学期阶段测试化学试题湖南省长沙市实验中学2020—2021学年高一上学期第一次月考(10月)化学试题(已下线)【浙江新东方】61河南省许昌市建安区第一高级中学2020-2021学年高一上学期阶段性测试(12月)化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题(已下线)练习4 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版)安徽省六安市城南中学2021届高三上学期第二次月考化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题(已下线)专题04 氧化还原反应-备战2021届高考化学二轮复习题型专练甘肃省镇原县第二中学2020-2021学年高一上学期期中考试化学试题云南省保山市第九中学2021届高三上学期期中考试化学试题安徽省江淮名校2020-2021学年高一下学期开学联考化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题黑龙江省哈尔滨市第三中学2020-2021学年高一上学期期末考试化学试卷(已下线)衔接点07 氧化剂和还原剂-2021年初升高化学无忧衔接(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省泗县第一中学2021-2022学年高二上学期开学考试化学试题河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题湖南省益阳市箴言中学2021-2022学年高一上学期10月月考化学试题 黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题湖南省邵阳市邵东创新实验学校2021-2022学年高三上学期第一次月考化学试题湖北省巴东县第一高级中学2021-2022学年高一上学期第一次教学质量检测化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)安徽省合肥市第六中学2020-2021学年高一上学期第一次月考化学试题(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点巩固卷02 化学物质及其变化(3大考点44题)?-2024年高考化学一轮复习考点通关卷(新高考通用)第2课时 氧化剂和还原剂湖南省长沙市长郡中学2023-2024学年高一上学期第一次月考化学试题甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题湖南省永州市第一中学2023-2024学年高一上学期第一次月考化学试题安徽省亳州市第二完全中学2023-2024学年高一上学期期末考试化学试题海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题A卷黑龙江省哈尔滨市第三中学校2023-2024学年高一下学期寒假验收考试 化学试卷陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题



